Nguyễn Phạm Tuyết Nhi, Nhóm nghiên cứu Vi sinh Y học, Trường Đại học Quốc tế ĐHQG-HCM
PGS.TS Nguyễn Thị Thu Hoài, Nhóm nghiên cứu Vi sinh Y học, Trường Đại học Quốc tế ĐHQG-HCM
(Lược dịch nội dung chính từ “A global effort to dissect the human genetic basis of resistance to SARS-CoV-2 infection” của tác giả Evangelos Andreakos và cs (TLTK số [1]).
---------
Sơ lược
Trong suốt chiều dài lịch sử, các bệnh truyền nhiễm đã gây một áp lực chọn lọc mạnh mẽ lên con người. Đại dịch COVID-19 kéo dài từ tháng 12 năm 2019 đến nay là minh chứng, nhắc nhở chúng ta rằng bệnh nhiễm trùng, đặc biệt là các đại dịch về vi rút, là căn bệnh có khả năng lan truyền nhanh chóng và có thể dẫn tới tình trạng tử vong hàng loạt trên toàn thế giới.
Sự khác biệt trong biểu hiện lâm sàng của cơ thể đối với bệnh truyền nhiễm, ít nhất ở một số cá nhân, có thể được giải thích bởi các yếu tố di truyền của con người. Các dữ liệu về dịch tễ học được ghi chép cho thấy mức độ chuyển biến triệu chứng giữa các cá nhân nhiễm vi rút SARS-CoV-2 có sự khác biệt vô cùng lớn, từ không có triệu chứng đến các trường hợp đe dọa đến tính mạng. Các ‘rối loạn di truyền bẩm sinh’ (inborn errors) và các ‘tự kháng thể’ (auto-antibodies) trong cơ thể được định hướng để chống lại các interferon loại I (IFN-I) chiếm khoảng 20% các trường hợp nhiễm vi rút SARS-CoV-2 có triệu chứng nghiêm trọng.
Trong khi đó, các yếu tố di truyền và miễn dịch về khả năng kháng vi rút SARS-CoV-2 tự nhiên vẫn chưa được khám phá. Hiện tượng này đã được quan sát thấy ở một số bệnh khác, chẳng hạn như đột biến thay thế tạo ra alen im lặng ở thụ thể chemokine DARC giúp có khả năng kháng Plasmodium vivax (một loài ký sinh trùng phổ biến nhất trong số các loài gây bệnh sốt rét; muỗi Anopheles là trung gian truyền bệnh. Hơn một phần ba dân số thế giới, gần 2,5 tỷ người, có nguy cơ nhiễm bệnh sốt rét do P. vivax. [2]), đột biến mất đoạn ở thụ thể chemokine 5 (CCR5) tạo ra khả năng kháng lại HIV-1, ngoài ra đồng hợp tử lặn của gen FUT2 trong nhóm máu ABH đã được chứng minh làm cơ sở kháng norovirus (nguyên nhân phổ biến nhất của viêm dạ dày ruột). Với vi rút SARS-CoV-2, một số bằng chứng cho thấy có sự liên quan giữa cơ sở di truyền và miễn dịch bẩm sinh về khả năng kháng vi rút Sars-CoV-2, ví dụ: tỷ lệ tái nhiễm (SAR-Secondary Attack Rate) trung bình đối với các trường hợp nhiễm vi rút SARS-CoV-2 có thể lên tới 70% trong các hộ gia đình cụ thể và một số gia đình đã được ghi nhận rằng tất cả các thành viên đều bị nhiễm bệnh, ngoại trừ một số cá nhân (vợ hoặc chồng) dù ở trong môi trường phơi nhiễm cao nhưng lại không mắc COVID-19. Vì vậy, một chiến lược nhằm xác định, tuyển chọn và phân tích cơ sở di truyền ở những cá nhân có khả năng bẩm sinh kháng SARS-CoV-2 một cách tự nhiên là cần thiết.
Tính nhạy cảm bẩm sinh (inborn susceptibility) đối với các bệnh truyền nhiễm đe dọa tính mạng
Quá trình tiến hóa của con người được đánh dấu bởi các vi sinh vật đủ khả năng gây bệnh nhằm tạo ra áp lực chọn lọc lên các gen quan trọng trong việc bảo vệ vật chủ khỏi mầm bệnh. Một trong những thảm họa nguy hiểm nhất đối với sức khỏe con người là bệnh lao, nguyên nhân gây ra khoảng một tỷ ca tử vong ở châu Âu trong hai thiên niên kỷ qua. Nghịch lý thay, chỉ có ít hơn 10% người nhiễm vi khuẩn Mycobacterium tuberculosis phát triển thành bệnh lao.
Kể từ đầu thế kỷ XX, di truyền học ở người, liên quan đến cơ chế bệnh sinh (pathogenesis) của bệnh lao đã được giải mã thông qua các nghiên cứu thực nghiệm và di truyền học cổ điển. Gần đây, các ‘rối loạn miễn dịch bẩm sinh’ hiếm gặp (IEIs-inborn errors of immunity), bao gồm sự thiếu hụt gen lặn ở thụ thể interleukin-12 β1 (IL12RB1) và tyrosine kinase 2 (TYK2), đặc biệt được xác định ở một số người mắc bệnh lao.
Mức độ liên quan mật thiết hơn của phát hiện này đã được chỉ ra khi mở rộng phân tích sang các biến thể phổ biến hơn, cho thấy rằng đồng hợp tử (homozygosity) đối với tính đa hình TYK2 (P1104A) có liên quan đến nguy cơ lây nhiễm và phát triển thành bệnh lao cao. Đồng hợp tử P1104A đã phá vỡ khả năng của TYK2 trong việc tạo trung gian miễn dịch của ‘IFN-γ phụ thuộc IL-23’ đối với mycobacteria.
Sự xuất hiện của đại dịch COVID-19 góp phần chứng minh rằng các rối loạn miễn dịch bẩm sinh (IEIs) có vai trò trong việc xác định tính nhạy cảm đối với trường hợp mắc COVID-19 nghiêm trọng. Theo COVID Human Genetic Effort, 23 người có vấn đề về IEIs ở tám vị trí locus chi phối sự cảm ứng và khuếch đại IFN loại I phụ thuộc vào TLR3 (Toll-like receptor 3) và IRF7 (interferon regulatory factor 7). Đáng chú ý, bốn người trưởng thành, khỏe mạnh và không có quan hệ huyết thống ở nghiên cứu này được báo cáo biểu hiện tính trạng lặn IRF7 hoặc thiếu hụt IFNAR1.
Mặc dù hiếm gặp, những cá nhân có IEIs chứng minh rằng miễn dịch bằng IFN loại I là điều cần thiết trong việc kiểm soát lây nhiễm SARS-CoV-2. Điều này đã dẫn đến những phát hiện về sự tồn tại của các ‘tự kháng thể’ trung hòa (neutralizing auto-antibodies) nhằm chống lại IFN loại I được tìm thấy ở hơn 10% những người bị COVID-19 nặng.
Gần đây, nhóm nghiên cứu đã phát hiện ra rằng các ‘tự kháng thể’ trung hòa IFN loại I có trước nhiễm trùng SARS-CoV-2 [3] , nồng độ các ‘tự kháng thể’ trung hòa IFN loại I chiếm khoảng 20% bệnh nhân trên 70 tuổi bị viêm phổi nguy kịch và tổng số các trường hợp mắc COVID-19 tử vong.
Những phát hiện này chỉ ra rằng các ‘tự kháng thể’ trung hòa IFN loại I đại diện cho một loại bệnh tự miễn mắc phải không phổ biến, góp phần gây ra khoảng 20% tổng số ca tử vong do COVID-19.
Khả năng ngăn nhiễm trùng bẩm sinh (Inborn resistance) khi tiếp xúc
Vào đầu những năm 1950, nghiên cứu của Anthony Allison đã chỉ ra rằng gen quy định tính trạng ‘hồng cầu hình liềm HbS’ có tần suất xuất hiện cao ở các khu vực châu Phi, nơi bệnh sốt rét lưu hành, giúp bảo vệ chống lại sự xâm nhiễm nghiêm trọng bởi ký sinh trùng Plasmodium falciparum gây ra do ưu thế dị hợp tử của alen.
Ngoài ra, một số ví dụ khác vẫn ghi nhận về khả năng bảo vệ chống lại sự nhiễm trùng kém, chẳng hạn như sự xuất hiện của các alen HLA loại I đặc hiệu, ở những người nhiễm HIV-1 không tiến triển trong thời gian dài và vai trò của một loại haplotype loại III (IFNL3-IFNL4) trong việc loại bỏ vi rút sau khi nhiễm vi rút viêm gan C. Các alen này có thể chống lại tình trạng tiến triển xấu của bệnh theo thời gian ở những người bị nhiễm bệnh, nhưng lại không có khả năng thu hẹp nhiễm trùng.
Những nghiên cứu liên quan đến các yếu tố di truyền trong khả năng chống lại nhiễm trùng cho đến nay, chỉ có ba cơ chế kháng Mendelian được xác định. Ở những năm 1970, Louis Miller đã phát hiện ra rằng sự vắng mặt của kháng nguyên Duffy trên các tế bào hồng cầu đã ngăn không cho các tế bào này bị nhiễm Plasmodium vivax. Cơ sở di truyền phân tử của tính trạng này vẫn chưa được xác định cho đến những năm 1990, một biến thể (gọi là ‘causal variant’) ảnh hưởng đến vị trí liên kết GATA-1 trong vùng gen khởi động ‘promoter DARC’ ngăn sự phiên mã gen ở tế bào hồng cầu một cách có chọn lọc.
Cùng lúc đó, sự thiếu hụt CCR5 bởi gen lặn trên NST thường được phát hiện có khả năng tạo ra khả năng chống nhiễm HIV-1. Đột biến mất chức năng phổ biến nhất ở CCR5 là đột biến mất 32 cặp bazơ, với tần số alen phụ là 10% ở quần thể châu Âu. Cuối cùng, sự thiếu hụt FUT2 bởi gen lặn trên NST thường được phát hiện đã tạo ra khả năng chống nhiễm trùng đường tiêu hóa đối với norovirus (vi rút viêm dạ dày/ruột, viêm dạ dày và ngộ độc thực phẩm [4]).
Có lẽ không phải ngẫu nhiên mà những ví dụ về khả năng chống lại nhiễm trùng của Mendel đều liên quan đến sự thiếu hụt hoàn toàn của các thụ thể hoặc các đồng thụ thể (co-receptors) bị mầm bệnh lợi dụng như một phương tiện xâm nhập vào tế bào. Các cơ chế di truyền chống lại các loại lây nhiễm nghiêm trọng cùng những cơ chế cơ bản để chống lại chính sự lây nhiễm đó, đều là đối tượng của chọn lọc dương tính (positive selection), vì chúng có thể mang lại lợi thế giúp cho chúng ta sống sót khi tiếp xúc với mầm bệnh.
Các gen “ứng cử viên” kháng vi rút SARS-CoV-2 tiềm năng
Mặc dù tỷ lệ người có khả năng kháng SARS-CoV-2 một cách tự nhiên vẫn chưa được thống kê, nhưng một số gen “ứng cử viên” liên quan đến khả năng đề kháng bẩm sinh của con người đối với SARS-CoV-2 đã xuất hiện qua một số nghiên cứu nhất định.
Một trong số đó là locus ABO, được xác định qua phương pháp nghiên cứu tương quan toàn bộ nhiễm sắc thể (Genome-wide association study (GWAS)). Tuy dữ liệu ban đầu về tác động của nhóm máu đối với mức độ nghiêm trọng của COVID-19 là không nhất quán, một phân tích tổng hợp mới đây với gần 50.000 người từ 46 nghiên cứu đã xác nhận có sự ảnh hưởng từ vị trí locus này đối với tính nhạy cảm của nhiễm trùng.
Dù chưa có cơ chế kháng bệnh thống nhất nào được đề xuất và tác dụng bảo vệ của alen O được xem là tương đối nhỏ, nhưng các nhóm máu ABO có thể đóng vai trò trực tiếp là đồng thụ thể của vi rút SARS-CoV-2.
Ngoài ra, một hiện tượng hiếm gặp ở bệnh nhân COVID-19, được gọi là ‘COVID toes’ (pseudo-chilblains), có biểu hiện giống với ‘bệnh cước’ (Chilblains: bệnh có các vết sưng tấy xuất hiện trên vùng da hở (ngón tay, mũi, ngón chân) khi thời tiết lạnh, ẩm ướt) và hội chứng Aicardi - Goutières, các rối loạn gen đơn gây ra bởi những đột biến dẫn đến sự tăng cường điều hòa tín hiệu IFN loại I [5].
Hầu hết những người có ‘COVID toes’ vẫn có huyết thanh âm tính (kết quả âm tính khi kiểm tra huyết thanh), nhưng vẫn quan sát được sự hiện diện của protein gai SARS-CoV-2 ở các mẫu sinh thiết da và sự đáp ứng cục bộ mạnh mẽ của IFN loại I, cho thấy rằng đã có sự đào thải vi rút ở giai đoạn sớm.
Bằng cách hiểu rõ sinh lý bệnh của hiện tượng này, chúng ta có thể làm sáng tỏ cơ chế mà vật chủ sử dụng để hạn chế sự nhân lên của vi rút và thúc đẩy khả năng phục hồi của cơ thể khi nhiễm SARS-CoV-2.
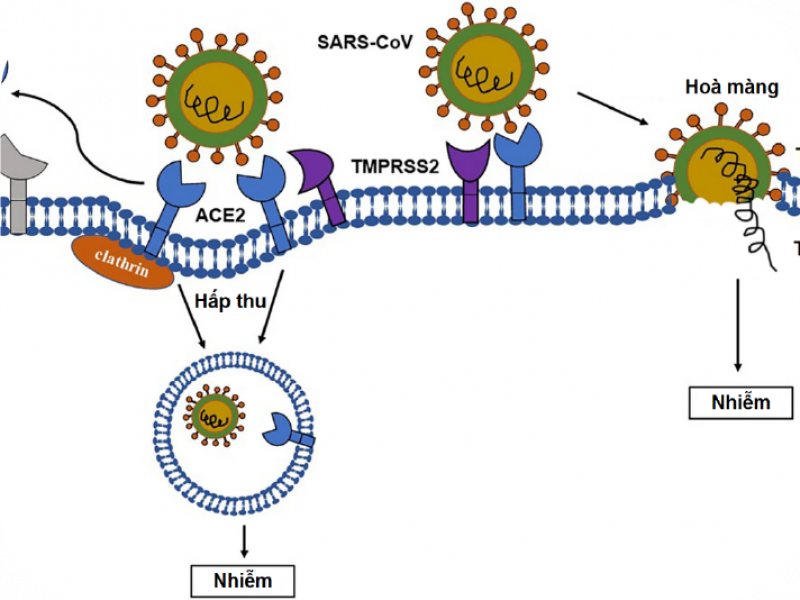
Khi tìm hiểu về cơ chế xâm nhập tế bào, người ta phát hiện ra rằng, SARS-CoV-2 nhắm vào thụ thể ACE2 và protease xuyên màng - serine protease TMPRSS2 để gắn vào protein gai. Một biến thể hiếm gặp nằm gần ACE2, được tìm thấy bởi phương pháp GWAS, mang lại khả năng bảo vệ, chống lại sự lây nhiễm SARS-CoV-2 bằng cách giảm sự biểu hiện của ACE2. Hơn nữa, một số đa hình của thụ thể ACE2 ở người liên kết với protein gai của SARS-CoV-2 bằng các ái lực khác nhau qua phương pháp nghiên cứu in vitro.
Phương pháp sàng lọc bộ nhiễm sắc thể sử dụng công nghệ CRISPR-Cas9 (Genome-wide CRISPR-Cas9 knockout screens) cho các bệnh gây ra bởi vi rút SARS-CoV-2 và các coronavirus khác đã phát hiện ra sự có mặt của một protein xuyên màng lưới nội chất - TMEM41B, khiến vi rút lây nhiễm một cách dễ dàng hơn. TMEM41B cũng được ghi nhận có mặt trong việc lây lan dịch bệnh liên quan đến Chi vi rút Flavi (Flaviviruses), tuy nhiên một alen phổ biến ở người Đông Nam Á đã được quan sát bằng phương pháp in vitro là có khả năng hỗ trợ chống lại flavivirus.
Bằng sự kết hợp giữa phương pháp sắc ký ái lực và khối phổ (affinity purification-mass spectrometry) dựa trên sự tương tác giữa protein của người với SARS-CoV-2, bản đồ tương tác mở rộng cho các protein được xây dựng. Các đánh giá về chức năng của hệ tương tác này giúp hình thành một danh mục các yếu tố vật chủ thiết yếu trong lây nhiễm SARS-CoV-2.
Mặc dù chưa có nghiên cứu nào trên người về mối tương tác giữa SARS-CoV-2 với khả năng dễ bị lây nhiễm ở người, nhưng các gen liên quan - cùng với các locus được GWAS xác định - có thể được coi là ứng cử viên sáng giá để tìm ra các biến thể bẩm sinh có khả năng kháng sự xâm nhiễm.
Các chiến lược nghiên cứu về di truyền và miễn dịch học
Có hai thách thức chính trong việc tìm kiếm các cá thể có khả năng kháng vi rút SARS-CoV-2 một cách tự nhiên. Đầu tiên là trở ngại trong chẩn đoán không có sự lây nhiễm. Phương pháp chẩn đoán phân tử dựa trên PCR, sử dụng mẫu bệnh phẩm từ đường hô hấp chỉ cung cấp thông tin mang tính thời điểm/nhất thời. Phương pháp xét nghiệm kháng thể/huyết thanh học (Serology) là một phương pháp rất hữu ích để đánh giá sự tồn tại của các bệnh tiền nhiễm, tuy nhiên, vẫn cho kết quả âm tính đối với nhiều trường hợp đã nhiễm vi rút, SARS-CoV-2. Phản ứng chéo (cross-reactive) miễn dịch qua trung gian tế bào T có được nhờ những lần xâm nhiễm trước đó của các coronavirus khác, cũng là một trong những nguyên nhân cho sự hồi phục nhanh khi nhiễm SARS-CoV-2. Ngoài ra, tế bào T đáp ứng với kháng nguyên đặc hiệu SARS-CoV-2 tạo ra dấu ấn (marker) nhạy và đặc hiệu để đánh giá mức độ xâm nhiễm SARS-CoV-2 trước đó.
Thách thức thứ hai nằm ở khả năng lây nhiễm vi rút. Khả năng lây nhiễm phụ thuộc vào cả thời gian và cường độ tiếp xúc với một cá thể bị nhiễm bệnh và các đặc điểm lây truyền tự nhiên nội tại (intrinsic transmission) của mầm bệnh. Hệ số lây truyền cơ bản (Basic reproduction number, R0), một thước đo dịch tễ học được sử dụng để đo khả năng lây truyền của các tác nhân truyền nhiễm [6], cho thấy số lần lây nhiễm thứ cấp trung bình do một trường hợp nhiễm bệnh điển hình trong một quần thể mà tất cả mọi người đều dễ mắc phải của SARS-CoV-2, trung bình từ 2,5 đến 5,0. Tuy nhiên, coronavirus có khả năng lan truyền nhanh chóng ở những sự kiện siêu lây nhiễm (superspreading events) với tỉ lệ tái nhiễm rất cao. Việc xác định các sự kiện này, các đợt bùng phát quy mô lớn khác và các hộ gia đình, trong đó, một hoặc rất ít cá nhân vẫn chưa bị nhiễm bệnh sẽ là mối quan tâm đặc biệt cho các nhà nghiên cứu về các biến thể bẩm sinh kháng vi rút SARS-CoV-2.
Dựa trên giả thuyết rằng các biến thể miễn dịch bẩm sinh đơn gen bẩm sinh có thể tạo ra khả năng đề kháng tự nhiên đối với sự xâm nhiễm của vi rút SARS-CoV-2, chiến lược bốn bước được đề xuất nhằm khắc phục các hạn chế về chẩn đoán và phơi nhiễm. Trước tiên, tập trung vào hộ gia đình không bị nhiễm bệnh dù đã tiếp xúc với những người có triệu chứng COVID-19 (được đánh giá 3 điểm trở lên theo thang điểm diễn tiến lâm sàng của Tổ chức Y tế Thế giới). Tiếp theo, xem xét các cá nhân tiếp xúc với trường hợp nhiễm bệnh mà không có vật dụng bảo vệ cá nhân (ít nhất 1 giờ/ngày và trong 3-5 ngày kể từ lúc xuất hiện các triệu chứng đầu tiên theo danh mục). Ưu tiên nghiên cứu về các cặp vợ/chồng và bạn tình có một người mắc COVID-19. Sau đó, ghi nhận những cá nhân có kết quả PCR âm tính, đồng thời kết quả xét nghiệm kháng thể âm tính sau 4 tuần phơi nhiễm. Cuối cùng, đánh giá đáp ứng của tế bào T đặc hiệu với vi rút SARS-CoV-2 ở những cá thể có khả năng kháng và so sánh phản ứng của họ với phản ứng của những người bị nhiễm SARS-CoV-2 (Hình 1).
Ngoài ra, cần phân biệt các đáp ứng của tế bào T do tiêm chủng với các đáp ứng do lây nhiễm tự nhiên. Những người tham gia nghiên cứu nào không có đáp ứng tương tác giữa tế bào T và SARS-CoV-2 sẽ được phân tích bằng phương pháp giải trình tự toàn bộ hệ gen. Kết quả sẽ được so sánh, đối chiếu với mẫu dương tính SARS-CoV-2 (positive control), nhằm xác định các biến thể hiếm gặp hoặc phổ biến có tác động mạnh đến khả năng ngăn sự lây nhiễm. Cuối cùng, như trong các nghiên cứu về IEIs, các phát hiện khác biệt về mặt di truyền sẽ được xác nhận bằng thực nghiệm thông qua nghiên cứu tế bào của những người tham gia nghiên cứu, để phân tích cơ chế ngăn sự xâm nhiễm ở cấp độ phân tử, tế bào, mô, miễn dịch và toàn bộ cơ thể.
Kết luận
Những phát hiện về khả năng ngăn sự xâm nhiễm bẩm sinh đối với các bệnh lây nhiễm đã biết đã mở đường cho việc kiểm tra giả thuyết về đơn gen kháng sự xâm nhiễm SARS-CoV-2 bẩm sinh. Mặc dù một số biến thể bẩm sinh có khả năng ngăn sự xâm nhiễm của những gen tiềm năng có những tác động tương đối nhỏ, tuy nhiên, mục tiêu của chúng ta là xác định các gen chứa các biến thể hiếm tiềm năng với hiệu quả tác động lớn. Nhờ các biến thể này, chúng ta không những có thể hiểu sâu hơn về các con đường sinh học thiết yếu liên quan đến sự lây nhiễm của vi rút SARS-CoV-2, mà còn có thể thúc đẩy phát triển các liệu pháp can thiệp mới để ngăn ngừa hoặc điều trị sự xâm nhiễm vi rút SARS-CoV-2.
Tài liệu tham khảo
- Andreakos, E., et al., A global effort to dissect the human genetic basis of resistance to SARS-CoV-2 infection. Nature Immunology, 2021. https://doi.org/10.1038/s41590-021-01030-z.
- Menkin-Smith, L. and W.T. Winders, Plasmodium Vivax Malaria, in StatPearls. 2021: Treasure Island (FL).
- Bastard, P., et al., Autoantibodies neutralizing type I IFNs are present in ~4% of uninfected individuals over 70 years old and account for ~20% of COVID-19 deaths. 2021. 6(62): p. eabl4340. https://www.science.org/doi/abs/10.1126/sciimmunol.abl4340
- BOSTON PUBLIC HEALTH COMMISSION| FACT SHEET-Norovirus. March 2014; https://www.bphc.org/whatwedo/infectious-diseases/Infectious-Diseases-A-to-Z/Documents/Fact%20Sheet%20Languages/Norovirus/Vietnamese.pdf.
- COVID Toes and Chilblains. https://www.skinsight.com/skin-conditions/child/covid-toes-and-chilblains.
- Achaiah, N.C., S.B. Subbarajasetty, and R.M. Shetty, R(0) and R(e) of COVID-19: Can We Predict When the Pandemic Outbreak will be Contained? Indian J Crit Care Med, 2020. 24(11): p. 1125-1127. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7751056/.
- Researchers provide new insights into SARS-CoV-2 lung pathology. 3 December 2020, Hannah Balfour (Drug Target Review).









Hãy là người bình luận đầu tiên