Lê Đình Tố1,2 , Nguyễn Trí Nhân1
1 Khoa Sinh học - Công nghệ Sinh học, Trường Đại học Khoa học Tự nhiên, ĐHQG-HCM
2 Department of Cellular and Molecular Biotechnology, Faculty of Technology, Bielefeld University, Germany
---------------
1. Các biến thể SARS-CoV-2
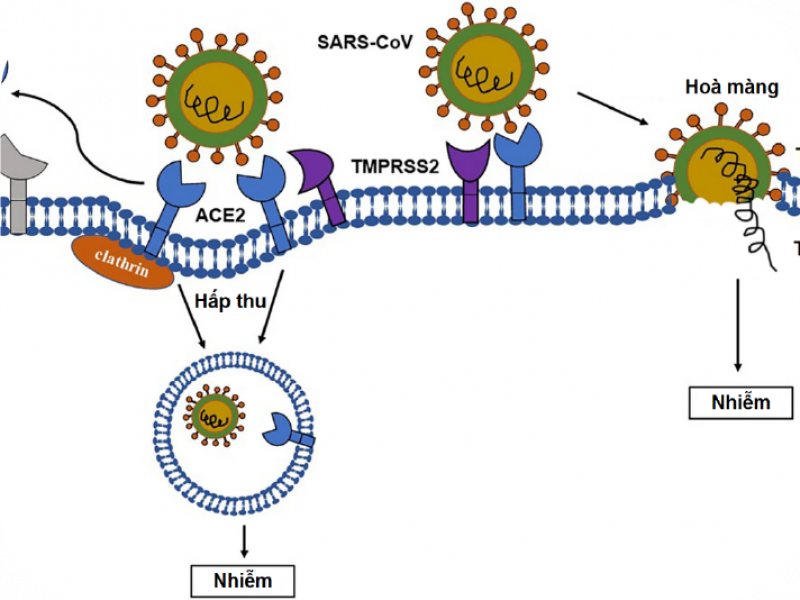
Virus corona 2 gây hội chứng hô hấp cấp tính nặng (SARS-CoV-2) gây bệnh viêm đường hô hấp ở người, được ghi nhận lần đầu tiên vào khoảng tháng 12 năm 2019 tại thành phố Vũ Hán, Trung Quốc, sau đó lây lan toàn cầu gây nên đại dịch COVID-19. Do thuộc nhóm RNA virus, bộ gene của SARS-CoV-2 liên tục xảy ra các đột biến dẫn đến hình thành nhiều biến thể khác nhau. Hai nhóm biến thể được Tổ chức Y tế Thế giới (WHO) phân loại và đề nghị theo dõi là: biến thể đáng lo ngại (variant of concern, VOC) và biến thể cần quan tâm (variant of interest, VOI) [1].
Các biến thể VOC được tóm tắt ở Bảng 1, với các khả năng thoát miễn dịch khác nhau, được đánh giá dựa trên khả năng thoát kháng thể trung hòa trong phòng thí nghiệm. Hiện nay, chưa có bằng chứng khoa học rõ ràng chứng minh các biến thể này gây bệnh nặng hơn chủng gốc ban đầu ở Vũ Hán. Tuy nhiên, tất cả bốn biến thể VOC đều làm tăng khả năng lây nhiễm so với chủng gốc [2–5]. Trong đó, biến thể Delta có nguốn gốc từ Ấn Độ được cho là có khả năng lây nhiễm nhanh (gấp 1,5-2 lần so với biến thể Alpha có nguồn gốc từ Anh) [2] và thoát miễn dịch tốt nhất (cùng với biến thể Beta) [6].
Bảng 1. Các biến thể VOC theo phân loại của WHO và khả năng thoát miễn dịch của chúng (khả năng thoát kháng thể trung hòa in vitro) [6–8]
|
Ký hiệu biến thể |
Nơi phát hiện đầu tiên |
Khả năng thoát miễn dịch |
|
Alpha (B.1.1.7) |
Anh |
+ [7] |
|
Beta (B.1.351) |
Nam Phi |
++++ [6] |
|
Gamma (P.1) |
Brazil |
++ [8] |
|
Delta (B.1.617.2) |
Ấn Độ |
++++ [6] |
Các biến thể VOI như Eta (B.1.525) phát hiện ở nhiều quốc gia, Iota (B.1.526) phát hiện ở Mỹ, Kappa (B.1.617.1) phát hiện ở Ấn Độ và Lambda (C.37) phát hiện ở Peru cần được theo dõi và đánh giá thêm.
2. Vaccine ngừa SARS-CoV-2
2.1. Hiệu quả của các loại vaccine khác nhau
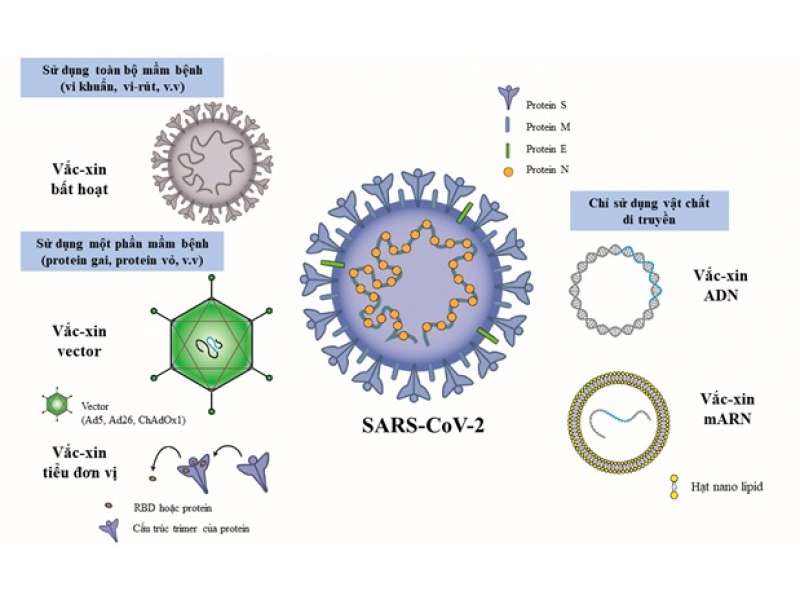
Hiện nay, có 6 loại vaccine được WHO cấp phép với bản chất và công nghệ khác nhau gồm: Pfizer/BioNtech (Mỹ/Đức) và Moderna (Mỹ) - công nghệ mRNA; Johnson and Johnson (J&J)/Janssen (Bỉ/Hà Lan/Mỹ) và Astrazeneca (Anh/Thụy Điển) - công nghệ vector adenovirus; Sinopharm và Sinovac (Trung Quốc) - công nghệ virus bất hoạt. Ngoài ra, vaccine Sputnik V của Nga, đã được cấp phép ở Việt Nam, cũng thuộc nhóm vector adenovirus. Hiệu quả của vaccine được đánh giá dựa trên số ca nhiễm (có triệu chứng và xét nghiệm PCR dương tính) ở nhóm tiêm vaccine so với nhóm tiêm giả dược, trong thử nghiệm lâm sàng pha 3. Các kết quả về hiệu quả này phần lớn trên virus SARS-CoV-2 phát hiện ở Vũ Hán ban đầu. Ngoài hiệu quả ngăn ngừa các ca nhiễm có triệu chứng, hiệu quả vaccine trong ngăn ngừa nhập viện và tử vong cũng được đánh giá.
Đối với các biến thể mới xuất hiện, hiệu quả của vaccine có thể được đánh giá sơ bộ bằng “phương pháp phòng thí nghiệm”, dựa trên khả năng trung hòa virus bởi huyết thanh của người được tiêm vaccine. Hiệu quả của các loại vaccine đối với virus Vũ Hán (từ kết quả thử nghiệm lâm sàng pha 3) và đối với biến thể Delta được tổng hợp ở Bảng 2.
Bảng 2. Các loại vaccine được cấp phép và hiệu quả của chúng
|
Vaccine |
Công nghệ sản xuất |
Cấp phép |
Hiệu quả trong thử nghiệm lâm sàng pha 3 |
Hiệu quả với biến thể Delta |
|||
|
WHO |
Việt Nam |
Phòng thí nghiệm |
Ngăn ngừa ca nhiễm |
Ngăn ngừa nhập viện và tử vong |
|||
|
Pfizer/BioNtech |
mRNA |
✓ |
✓ |
95,1% [9] |
✓ |
79,0-88,0% [10,11] |
96,0% |
|
Moderna |
mRNA |
✓ | ✓ |
94,1% [13] |
✓ |
72,0%a [15] |
96,0%a |
|
Astrazeneca |
vector virus |
✓ | ✓ |
55,1-81,3%b [16] |
✓ |
60,0-67,0% [10,11] |
92,0% |
|
J&J/Janssen |
vector virus |
✓ |
66,9% [17] |
✓ |
- |
- |
|
|
Sputnik V |
vector virus |
chưa |
✓ |
91,6% [19] |
- |
- |
- |
|
Sinopharm |
virus bất hoạt |
✓ |
✓ |
78,1% [20] |
- |
- |
- |
|
Sinovac |
virus bất hoạt |
✓ |
chưa |
50,7-83,5%c [21] |
- |
- |
- |
a Hiệu quả được tính 14 ngày sau mũi 1. Hiệu quả sau mũi 2 đang được tiếp tục theo dõi.
b Hiệu quả tăng khi tăng thời gian giữa hai liều. Hiệu quả cao nhất trong nghiên cứu pha 3 khi khoảng cách giữa 2 liều là 12 tuần (81,3%).
c Kết quả bảo vệ từ thực nghiệm (real-world data) ở Chile (65,9%).
(-): chưa có dữ liệu.
Dựa trên bảng 2 cho thấy, hiện tại tất cả các vaccine được WHO và Việt Nam cấp phép đều có hiệu quả ít nhất 50% đối với virus SARS-CoV-2 Vũ Hán. Đối với biến thể Delta phổ biến hiện nay, các phân tích ban đầu cho thấy vaccine của Pfizer/BioNtech, Moderna, Astrazeneca và Janssen có hiệu quả bảo vệ ở các mức độ khác nhau. Cụ thể, hiệu quả ngăn ngừa các ca nhiễm (có triệu chứng) của Pfizer/BioNtech đối với virus Vũ Hán và biến thể Alpha lần lượt là 95,1% và 93,7%, sau khi tiêm đủ 2 mũi, còn với biến thể Delta, hiệu quả này giảm xuống còn khoảng từ 79,0-88,0%. Tuy nhiên hiệu quả ngăn ngừa các ca nặng và nhập viện của vaccine này vẫn được duy trì ở mức rất cao là 96,0%. Đối với vaccine Moderna, hiện chỉ có kết quả từ 14 ngày sau khi tiêm mũi một, cho hiệu quả ngăn ngừa các ca nhiễm biến thể Delta là khoảng 72,0%, và hiệu quả ngăn ngừa các ca nặng và nhập viện là 96,0%, tương đương khi tiêm Pfizer/BioNtech đủ 2 mũi. Các nghiên cứu về hiệu quả của vaccine Moderna sau 2 mũi vẫn đang được theo dõi.
Đối với vaccine vector virus Astrazeneca, sau khi tiêm 2 mũi và mũi hai cách mũi một 12 tuần thì hiệu quả ngừa ca nhiễm đối với virus Vũ Hán và biến thể Alpha là 81,3% và 74,5%. Hiệu quả ngăn ngừa ca nhiễm đối với biến thể Delta giảm còn 60,0-67,0% nhưng hiệu quả ngăn ngừa nhập viện của vaccine này vẫn ở mức cao là 92,0%. Vaccine này có hiệu quả thấp với biến thể Beta, xuất hiện đầu tiên ở Nam Phi [22]. Vaccine J&J/Janssen (chỉ tiêm 1 mũi) có hiệu quả bảo vệ khoảng 66,9% trong thử nghiệm lâm sàng pha 3 trên virus Vũ Hán. Đối với biến thể Delta, vaccine này hiện chỉ có kết quả trong phòng thí nghiệm, cho thấy kháng thể tạo ra sau khi tiêm vaccine có thể trung hòa biến thể Delta, còn hiệu quả ngăn ngừa ca nhiễm thì chưa có công bố nào đề cập. Các vaccine khác như Sputnik V, Sinopharm (Bắc Kinh) và Sinovac đều có hiệu quả ngăn ngừa ca nhiễm trong thử nghiệm lâm sàng pha 3 trên 50,0% (Bảng 2), tuy nhiên hiệu quả bảo vệ của các loại vaccine này với biến thể Delta vẫn đang được theo dõi thêm.
Hiệu quả bảo vệ của các vaccine nêu trên đều được tính tại thời điểm 14 ngày sau khi đã hoàn thành 2 liều tiêm (ngoại trừ J&J/Janssen chỉ cần tiêm một liều). Hiệu quả bảo vệ khi chỉ mới được tiêm mũi 1 của những vaccine cần tiêm 2 liều đều thấp hơn nhiều so với khi tiêm đủ 2 mũi [10], do đó việc tiêm đủ liều rất quan trọng để bảo vệ trước các biến thể.
Các vaccine đều mới được cấp phép sử dụng nên thời gian bảo vệ sau khi tiêm chủng vẫn chưa rõ. Các nghiên cứu ban đầu của vaccine Moderna cho thấy lượng kháng thể sinh ra sau khi tiêm vaccine giảm dần theo thời gian, tuy nhiên lượng kháng thể được cho là vẫn đủ để bảo vệ sau 6 tháng [23]. Trong khi đó, hiệu quả ngăn ngừa ca nhiễm của vaccine Pfizer/BioNtech giảm từ hơn 96,2% xuống 83,7% sau 6 tháng, tuy nhiên hiệu quả ngăn ngừa triệu chứng nặng vẫn duy trì ở mức cao là 97,0% [24]. Trong một nghiên cứu khác, vaccine Pfizer/BioNtech có khả năng kích thích tạo tế bào B phản ứng lâu dài [25], mang đến hy vọng về thời gian bảo vệ dài hạn của vaccine này.
Để đạt miễn dịch cộng đồng, đối với virus Vũ Hán trước đây, ước tính cần ít nhất khoảng 60-70% dân số tiêm vaccine, tuy nhiên vì nhiều biến thể mới xuất hiện, thời gian bảo vệ và khả năng chống lây nhiễm của vaccine chưa rõ, nên tỉ lệ số người tiêm vaccine ước tính cần nhiều hơn [26]. Hiện tại, vaccine chỉ phần lớn cấp phép cho người từ 18 tuổi trở lên (ngoại trừ vaccine Pfizer/BioNtech được cấp phép bởi Cơ quan quản lý thực phẩm và dược phẩm Mỹ (FDA), Pfizer/BioNtech và Moderna được cấp phép bởi Cơ quan quản lý dược phẩm châu Âu (EMA) cho sử dụng ở trẻ em từ 12-17 tuổi). Do đó, những ai đủ điều kiện tiêm chủng nên thực hiện tiêm vaccine để bảo vệ bản thân và người chưa đủ điều kiện tiêm chủng (trẻ em, người có bệnh nền không thể tiêm vaccine).
2.2. Tác dụng phụ của vaccine
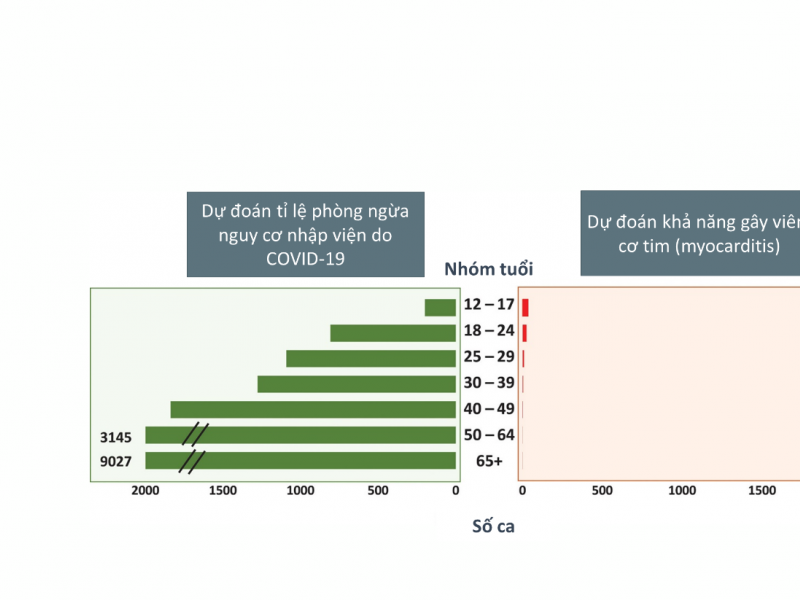
Phần lớn các vaccine đang sử dụng đều có một số tác dụng phụ thông thường như đau ở vị trí tiêm, mệt mỏi, đau đầu, sốt nhẹ,... Ngoài ra còn một số tác dụng phụ đáng lưu ý khác như sốc phản vệ, đông máu kết hợp giảm lượng tiểu cầu và viêm cơ tim.
Sốc phản vệ là phản ứng dị ứng tức thời của cơ thể đối với các thành phần của vaccine, được ghi nhận ở mức độ rất hiếm và xảy ra hầu hết với các loại vaccine đang sử dụng. Sốc phản vệ thường diễn biến rất nhanh sau khi tiêm vaccine (thường khoảng 15 phút sau khi tiêm) với các triệu chứng thông thường như nổi mề đay toàn thân, ban đỏ, phù mạch, các triệu chứng tắc nghẽn đường hô hấp, và buồn nôn [27]. Tỉ lệ các ca sốc phản vệ sau khi tiêm vaccine là 2 đến 5 người trên 1 triệu người (CDC, Mỹ) [28]. Vì vậy, sau khi tiêm vaccine, người được tiêm cần được theo dõi khoảng 30 phút tại cơ sở y tế và người có tiền sử dị ứng cần cẩn trọng với việc tiêm vaccine.
Tình trạng đông máu kết hợp với giảm lượng tiểu cầu có thể xảy ra khi tiêm vaccine Astrazeneca hoặc Janssen. Đối với Astrazeneca, tỉ lệ xảy ra tác dụng phụ này là 1/100.000 người theo ghi nhận của EMA [29] và khoảng 0,61/1 triệu liều được ghi nhận ở Ấn Độ [30]. Với vaccine Janssen, tần suất gây đông máu thấp hơn với khoảng 1/1 triệu người (FDA, Mỹ) [31]. Phần lớn các ca đông máu này đều được điều trị khỏi khi phát hiện sớm.
Ngoài ra, tình trạng viêm cơ tim hiếm gặp còn được ghi nhận sau khi tiêm vaccine của Pfizer/BioNtech và Moderna với tỉ lệ khoảng 1/400.000 người (CDC, Mỹ) [28,32], thường xuất hiện ở thiếu niên nam và sau khi tiêm mũi 2 [32,33]. Người xuất hiện tác dụng phụ này đều được điều trị khỏi và tránh các biến chứng khi được phát hiện sớm.
Tóm lại, các vaccine được WHO và Việt Nam chấp nhận hầu hết đều có tác dụng phụ tương đối nhẹ, ở mức kiểm soát được nếu phát hiện sớm. So với những biến chứng và tỉ lệ tử vong khi bị nhiễm SARS-CoV-2 thì rủi ro do tác dụng phụ của tiêm vaccine vẫn thấp hơn nhiều.
2.3. Tiêm kết hợp các vaccine khác nhau
Việc tiêm trộn các loại vaccine hiện chỉ có kết quả đánh giá khả năng sinh miễn dịch và tính an toàn khi tiêm kết hợp mũi 1 Astrazeneca và mũi 2 Pfizer/BioNtech hoặc Moderna, và thực hiện trên cỡ mẫu nhỏ (khoảng vài trăm người) [34–39]. Kết quả ban đầu cho thấy đáp ứng miễn dịch của việc tiêm trộn 2 loại vaccine này tốt hơn tiêm 2 mũi Astrazeneca. Về tác dụng phụ, một nghiên cứu cho thấy tiêm mũi 2 Pfizer/BioNtech cách mũi 1 Astrazeneca 4 tuần ghi nhận tác dụng phụ nhiều hơn (nhưng không nghiêm trọng) [35], trong khi một nghiên cứu khác ghi nhận một số tác dụng phụ (không nghiêm trọng) tương đương như tiêm 2 mũi Astrazeneca hoặc ít hơn khi tiêm mũi 2 Pfizer/BioNtech cách mũi 1 Astrazeneca từ 9-12 tuần [36]. Vì vậy, với dữ liệu hiện tại, việc tiêm trộn vaccine (mũi 1 Astrazeneca, mũi 2 Pfizer/BioNtech hoặc Moderna) có thể chấp nhận được.
Tài liệu tham khảo
- WHO Tracking SARS-CoV-2 variants Available online: https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/.
- Neil M Ferguson, MRC Centre for Global Infectious Disease Analaysis, I.C.L. B.1.617.2 transmission in England: risk factors and transmission advantage. PrePrint 2021.
- Davies, N.G.; Abbott, S.; Barnard, R.C.; Jarvis, C.I.; Kucharski, A.J.; Munday, J.D.; Pearson, C.A.B.; Russell, T.W.; Tully, D.C.; Washburne, A.D.; et al. Estimated transmissibility and impact of SARS-CoV-2 lineage B.1.1.7 in England. Science (80-. ). 2021, 372, eabg3055.
- Pearson, C.A.; Russell, T.W.; Davies, N.G.; Kucharski, A.J.; CMMID COVID-19 working group; Edmunds, W.J.; Eggo, R.M. Estimates of severity and transmissibility of novel South Africa SARS-CoV-2 variant 501Y.V2. Preprint 2021, 50, 1–4.
- Faria, N.R.; Mellan, T.A.; Whittaker, C.; Claro, I.M.; Candido, D. da S.; Mishra, S.; Crispim, M.A.E.; Sales, F.C.S.; Hawryluk, I.; McCrone, J.T.; et al. Genomics and epidemiology of the P.1 SARS-CoV-2 lineage in Manaus, Brazil. Science (80-. ). 2021, 372, 815–821.
- Davis, A.C.; Logan, N.; Tyson, G.; Orton, R.; Harvey, W.; Perkins, J.; Genomics, T.C.-; Consortium, U.K.C.; Thomas, P. Reduced neutralisation of the Delta (B.1.617.2) SARS-CoV-2 variant of concern following vaccination. medRxiv 2021.
- Shen, X.; Tang, H.; McDanal, C.; Wagh, K.; Fischer, W.; Theiler, J.; Yoon, H.; Li, D.; Haynes, B.F.; Sanders, K.O.; et al. SARS-CoV-2 variant B.1.1.7 is susceptible to neutralizing antibodies elicited by ancestral spike vaccines. Cell Host Microbe 2021, 29, 529-539.e3.
- Garcia-beltran, W.F.; Lam, E.C.; Denis, K.S.; Nitido, A.D.; Zeidy, H. Circulating SARS-CoV-2 variants escape neutralization by vaccine-induced humoral immunity. Medicamundi 2021.
- Polack, F.P.; Thomas, S.J.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, J.L.; Pérez Marc, G.; Moreira, E.D.; Zerbini, C.; et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N. Engl. J. Med. 2020, 383, 2603–2615.
- Sheikh, A.; McMenamin, J.; Taylor, B.; Robertson, C. SARS-CoV-2 Delta VOC in Scotland: demographics, risk of hospital admission, and vaccine effectiveness. Lancet 2021, 397, 2461–2462.
- Bernal, J.L.; Andrews, N.; Gower, C.; Gallagher, E.; Simmons, R.; Thelwall, S.; Stowe, J.; Tessier, E.; Groves, N.; Dabrera, G.; et al. Effectiveness of COVID-19 vaccines against the B.1.617.2 variant. medRxiv 2021, 2021.05.22.21257658.
- Stowe, J.; Andrews, N.; Gower, C.; Gallagher, E.; Utsi, L.; Simmons, R.; Thelwall, S.; Tessier, E.; Groves, N.; Dabrera, G.; et al. Effectiveness of COVID-19 vaccines against hospital admission with the Delta (B.1.617.2) variant. Public Heal. Engl. 2021, 37, https://khub.net/web/phe-national/public-library.
- Baden, L.R.; El Sahly, H.M.; Essink, B.; Kotloff, K.; Frey, S.; Novak, R.; Diemert, D.; Spector, S.A.; Rouphael, N.; Creech, C.B.; et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N. Engl. J. Med. 2021, 384, 403–416.
- Choi, A.A.; Koch, M.; Wu, K.; Dixon, G.; Legault, H.; Jones, G.B.E.S.; Colpitts, T.; Pajon, R.; Bennett, H.; Carfi, A.; et al. Serum Neutralizing Activity of mRNA-1273 against SARS-CoV-2 Variants. bioRxiv Prepr. 2021, 1–12.
- Gubbay, J.B.; Buchan, S.A.; Wilson, S.E.; Austin, P.C.; Schwartz, K.L.; Pharmd, M.T. Effectiveness of COVID-19 vaccines against variants of concern, Canada. medRxiv 2021.
- Voysey, M.; Costa Clemens, S.A.; Madhi, S.A.; Weckx, L.Y.; Folegatti, P.M.; Aley, P.K.; Angus, B.; Baillie, V.L.; Barnabas, S.L.; Bhorat, Q.E.; et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet 2021, 397, 881–891.
- Sadoff, J.; Gray, G.; Vandebosch, A.; Cárdenas, V.; Shukarev, G.; Grinsztejn, B.; Goepfert, P.A.; Truyers, C.; Fennema, H.; Spiessens, B.; et al. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19. N. Engl. J. Med. 2021, 384, 2187–2201.
- Barouch, D.H.; Stephenson, K.E.; Sadoff, J.; Yu, J.; Chang, A.; Gebre, M.; McMahan, K.; Liu, J.; Chandrashekar, A.; Patel, S.; et al. Durable Humoral and Cellular Immune Responses 8 Months after Ad26.COV2.S Vaccination. N. Engl. J. Med. 2021, February, NEJMc2108829.
- Logunov, D.Y.; Dolzhikova, I. V.; Shcheblyakov, D. V.; Tukhvatulin, A.I.; Zubkova, O. V.; Dzharullaeva, A.S.; Kovyrshina, A. V.; Lubenets, N.L.; Grousova, D.M.; Erokhova, A.S.; et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021, 397, 671–681.
- Al Kaabi, N.; Zhang, Y.; Xia, S.; Yang, Y.; Al Qahtani, M.M.; Abdulrazzaq, N.; Al Nusair, M.; Hassany, M.; Jawad, J.S.; Abdalla, J.; et al. Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults. JAMA 2021, 326, 35.
- Jara, A.; Undurraga, E.A.; González, C.; Paredes, F.; Fontecilla, T.; Jara, G.; Pizarro, A.; Acevedo, J.; Leo, K.; Leon, F.; et al. Effectiveness of an Inactivated SARS-CoV-2 Vaccine in Chile. N. Engl. J. Med. 2021, 1–11.
- Madhi, S.A.; Baillie, V.; Cutland, C.L.; Voysey, M.; Koen, A.L.; Fairlie, L.; Padayachee, S.D.; Dheda, K.; Barnabas, S.L.; Bhorat, Q.E.; et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant. N. Engl. J. Med. 2021, 384, 1885–1898.
- Widge, A.T.; Rouphael, N.G.; Jackson, L.A.; Anderson, E.J.; Roberts, P.C.; Makhene, M.; Chappell, J.D.; Denison, M.R.; Stevens, L.J.; Pruijssers, A.J.; et al. Durability of Responses after SARS-CoV-2 mRNA-1273 Vaccination. N. Engl. J. Med. 2021, 384, 80–82.
- Gurtman, A.; Lockhart, S.; Perez, J.L.; Marc, G.P.; Polack, F.P.; Zerbini, C.; Bailey, R.; Sc, B.; Swanson, K.A.; Ph, D.; et al. Six Month Safety and Efficacy of the BNT162b2 mRNA COVID-19 Vaccine Stephen J. Thomas, M.D. 1 , Edson D. Moreira Jr., M.D. 2 , Nicholas Kitchin, M.D. medRxiv Prepr. 2021.
- Turner, J.S.; O’Halloran, J.A.; Kalaidina, E.; Kim, W.; Schmitz, A.J.; Zhou, J.Q.; Lei, T.; Thapa, M.; Chen, R.E.; Case, J.B.; et al. SARS-CoV-2 mRNA vaccines induce persistent human germinal centre responses. Nature 2021.
- Aschwanden, C. Five reasons why COVID herd immunity is probably impossible. Nature 2021, 591, 520–522.
- Shimabukuro, T.T.; Cole, M.; Su, J.R. Reports of Anaphylaxis After Receipt of mRNA COVID-19 Vaccines in the US—December 14, 2020-January 18, 2021. JAMA 2021, 325, 1101.
- CDC No Selected Adverse Events Reported after COVID-19 VaccinationTitle Available online: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/adverse-events.html (accessed on Aug 3, 2021).
- EMA AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets Available online: https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood.
- Welfare, M. of H. and F.; Bleeding Bleeding and clotting events following COVID vaccination miniscule in India National AEFI ( Adverse Event Following Immunization ) Committee submits report to the Union Health Ministry; 2021;
- FDA FDA and CDC Lift Recommended Pause on Johnson & Johnson (Janssen) COVID-19 Vaccine Use Following Thorough Safety Review; 2021;
- CDC Myocarditis and Pericarditis Following mRNA COVID-19 Vaccination Available online: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/myocarditis.html (accessed on Aug 3, 2021).
- EMA Comirnaty and Spikevax: possible link to very rare cases of myocarditis and pericarditis Available online: https://www.ema.europa.eu/en/news/comirnaty-spikevax-possible-link-very-rare-cases-myocarditis-pericarditis.
- Schmidt, T.; Klemis, V.; Schub, D.; Mihm, J.; Hielscher, F.; Abu-omar, A.; Schneitler, S.; Becker, S.L.; Gärtner, B.C.; Sester, M. Immunogenicity and reactogenicity of a heterologous COVID-19 prime-boost vaccination compared with homologous vaccine regimens. medRxiv 2021.
- Liu, X.; Shaw, R.H.; Stuart, A.S.; Greenland, M.; Dinesh, T.; Provstgaard-Morys, S.; Clutterbuck, E.; Ramasamy, M.N.; Aley, P.K.; Farooq Mujadidi, Y.; et al. Safety and Immunogenicity Report from the Com-COV Study – a Single-Blind Randomised Non-Inferiority Trial Comparing Heterologous And Homologous Prime-Boost Schedules with An Adenoviral Vectored and mRNA COVID-19 Vaccine. SSRN Electron. J. 2021.
- Borobia, A.M.; Carcas, A.J.; Pérez Olmeda, M.T.; Castaño, L.; Jesús Bertrán, M.; García-Pérez, J.; Campins, M.; Portolés, A.; Gonzalez-Perez, M.; García Morales, M.T.; et al. Reactogenicity and Immunogenicity of BNT162b2 in Subjects Having Received a First Dose of ChAdOx1s: Initial Results of a Randomised, Adaptive, Phase 2 Trial (CombiVacS). SSRN Electron. J. 2021.
- Barros-Martins, J.; Hammerschmidt, S.I.; Cossmann, A.; Odak, I.; Stankov, M. V; Morillas Ramos, G.; Dopfer-Jablonka, A.; Heidemann, A.; Ritter, C.; Friedrichsen, M.; et al. Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOx1 nCoV-19/BNT162b2 vaccination. Nat. Med. 2021.
- Hillus, D.; Schwarz, T.; Tober-Lau, P.; Hastor, H.; Thibeault, C.; Kasper, S.; Helbig, E.T.; Lippert, L.J.; Tscheak, P.; Schmidt, M.L.; et al. Safety, reactogenicity, and immunogenicity of homologous and heterologous prime-boost immunisation with ChAdOx1-nCoV19 and BNT162b2: a prospective cohort study. medRxiv 2021.
- Normark, J.; Vikström, L.; Gwon, Y.-D.; Persson, I.-L.; Edin, A.; Björsell, T.; Dernstedt, A.; Christ, W.; Tevell, S.; Evander, M.; et al. Heterologous ChAdOx1 nCoV-19 and mRNA-1273 Vaccination. N. Engl. J. Med. 2021, 69, NEJMc2110716.









Hãy là người bình luận đầu tiên