Lê Cát Anh, sinh viên Trường ĐH Quốc tế ĐHQG-HCM
PGS.TS Nguyễn Thị Thu Hoài, Nhóm nghiên cứu Vi sinh y học, Trường ĐH Quốc tế, ĐHQG-HCM
---------
1. Mở đầu
Cuộc chiến chống lại dịch bệnh viêm đường hô hấp cấp Covid-19 do vi rút SARS-CoV-2 gây ra đã chứng kiến sự phát triển vắc xin nhanh kỷ lục, với 112 ứng viên vắc xin Covid-19 đang được thử nghiệm lâm sàng và 183 ứng viên đang trong giai đoạn phát triển tiền lâm sàng trên toàn thế giới. Tính tới thời điểm hiện tại, đã có nhiều đơn vị công bố sản xuất vắc xin ngừa vi rút thành công, trong số đó đã có 8 vắc xin được tổ chức Y tế Thế giới (WHO) liệt kê vào danh sách sử dụng khẩn cấp và 13 vắc xin đang trong quá trình xem xét. Mỗi loại vắc xin có những cơ chế, tính chất hoạt động khác nhau, do vậy cũng có những ưu nhược điểm khác nhau. Dù có nhiều loại vắc xin nhưng nhìn chung chúng đều được tạo ra trên cơ sở 3 cách tiếp cận sau: 1) Dùng toàn bộ mầm bệnh; 2) Dùng một phần của mầm bệnh kích hoạt hệ thống miễn dịch; 3) Chỉ dùng vật liệu di truyền để tạo ra các protein đặc hiệu cho mầm bệnh (Hình 1). Bài viết này sẽ giới thiệu kiến thức cơ sở, phân tích ưu nhược của các cách tiếp cận và đưa ra đặc điểm riêng của các loại vắc xin phòng Covid-19, đặc biệt là những loại đã được cấp phép cho tới tháng 8/2021.
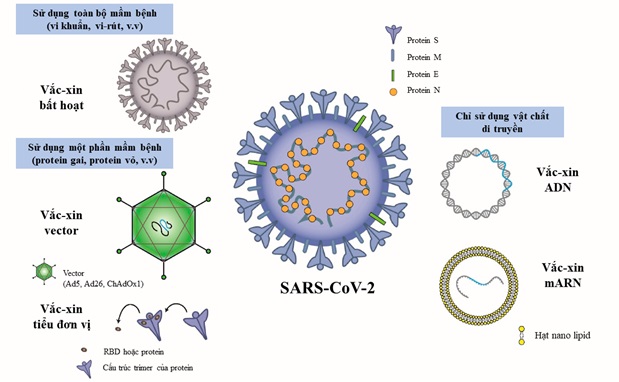
Nguồn: https://www.mdpi.com/2076-393X/9/6/588/htm
2. Cơ sở và ưu nhược điểm của các cách tiếp cận chính tạo vắc xin Covid-19
2.1. Sử dụng toàn bộ vi rút
Với vắc xin phòng Covid-19, hiện nay cách tiếp cận dùng vi rút toàn phần được thực hiện chủ yếu theo hướng tạo vắc xin bất hoạt chứa vi rút (SARS-CoV-2) mà vật chất di truyền của chúng đã bị phá hủy bởi nhiệt, hóa chất hoặc bức xạ, do đó không thể lây nhiễm và tái tạo tế bào, nhưng vẫn có thể kích hoạt phản ứng miễn dịch. Ưu điểm của loại vắc xin này là không chứa mầm bệnh sống dẫn đến không gây nguy cơ nhiễm bệnh do vắc xin; có khả năng tạo ra đáp ứng kháng thể cao; dễ bảo quản và sản xuất tương đối đơn giản, ổn định. Tuy nhiên, vắc xin bất hoạt có nhược điểm là chậm kích thích miễn dịch; đáp ứng miễn dịch tồn tại ngắn hơn so với vắc xin sống giảm độc lực; khả năng tạo miễn dịch tế bào hạn chế thậm chí không có; có nguy cơ phát triển sinh vật gây bệnh do phải nuôi cấy các vi rút trước khi bất hoạt; có nguy cơ vi rút không được bất hoạt hoàn toàn, dẫn tới khả năng gây bệnh; thường yêu cầu dùng tá dược bổ sung (phèn chua, nhũ tương); và vì là hỗn hợp kháng nguyên, dẫn tới đáp ứng miễn dịch tạo ra không tập trung vào các kháng nguyên có khả năng thực sự tạo ra miễn dịch bảo vệ.
2.2. Sử dụng một phần của vi rút
Với cách tiếp cận dùng một phần của vi rút, vắc xin phòng Covid-19 hiện có hai loại là vắc xin tiểu đơn vị và vắc xin vector.
2.2.1. Vắc xin tiểu đơn vị: Vắc xin này chứa các mảnh (protein) vô hại của vi rút SARS-CoV-2 thay vì toàn bộ mầm bệnh. Sau khi được tiêm chủng, protein của SARS-CoV-2 vào cơ thể và với bản chất ngoại lai sẽ kích thích hệ miễn dịch, tạo miễn dịch bảo vệ chống lại những protein này, qua đó chống lại SARS-CoV-2 nếu cơ thể gặp vi rút này trong tương lai. Vắc xin tiểu đơn vị protein có ưu điểm là được tạo ra bởi các mảnh không có khả năng gây bệnh nên rất an toàn; có thể sử dụng cho bệnh nhân suy giảm chức năng miễn dịch; có khả năng chịu được các điều kiện thay đổi như nhiệt độ, ánh sáng, độ ẩm. Nhược điểm của loại vắc xin này là khả năng sinh miễn dịch thường kém hơn so với vắc xin giảm độc lực; cần tiêm nhiều liều (liều tăng cường) để duy trì khả năng miễn dịch lâu dài; vài trường hợp khó phân lập kháng nguyên có khả năng kích hoạt phản ứng miễn dịch như mong muốn.
2.2.2. Vắc xin vector: Vắc xin vector có chứa một loại vi rút không gây bệnh trên người, nhưng vật liệu di truyền của nó đã được chỉnh sửa để mang một phần thông tin di truyền của SARS-CoV-2, vì vậy, vi rút này được gọi là "vector vi rút". Sau khi vector vi rút vào trong tế bào của chúng ta, vật chất di truyền sẽ cung cấp thông tin cho tế bào tạo protein đặc trưng của SARS-CoV-2. Protein này sẽ được tế bào xử lý, trình diện kháng nguyên và qua đó kích thích hệ miễn dịch, tạo miễn dịch bảo vệ chống lại SARS-CoV-2. Loại vắc xin này có ưu điểm là sản xuất đơn giản, dễ dàng dự trữ; chất lượng ổn định; giá thành không cao; và có thể cung cấp qua đường khí dung, đường uống, trong da và tiêm bắp. Tuy nhiên, nhược điểm của loại vắc xin này là có thể kém hiệu quả hơn so với vắc xin toàn phần do dùng vi rút làm vector, đặc biệt nếu cơ thể đã có miễn dịch với loại vector này; vật chất di truyền vi rút có khả năng tích hợp vào vật chất di truyền của tế bào, có thể ảnh hưởng đến các gen kiểm soát sự phát triển của tế bào.
2.3. Sử dụng vật chất di truyền
Cách tiếp cận dùng vật chất di truyền tạo ra vắc xin axit nucleic. Vắc xin axit nucleic phòng Covid-19 chỉ sử dụng một phần vật chất di truyền có thể là ARN hoặc ADN mang thông tin di truyền của SARS-CoV-2, cung cấp thông tin cho tế bào chúng ta tạo ra protein của SARS-CoV-2. Protein này sau khi được tạo ra sẽ được tế bào xử lý, trình diện kháng nguyên và qua đó kích thích hệ miễn dịch, tạo miễn dịch bảo vệ chống lại SARS-CoV-2. Về ưu điểm, vắc xin axit nucleic không cần vi rút sống, tạo đáp ứng miễn dịch hiệu quả bao gồm cả miễn dịch dịch thể và trung gian tế bào; phát triển và sản xuất nhanh chóng, đồng thời dễ dàng phát triển nhanh công nghệ áp dụng cho các biến thể hoặc vi rút khác. Bên cạnh đó, nhược điểm của loại vắc xin này là mARN dễ bị phân hủy, kém bền, cần bảo quản ở điều kiện lạnh sâu, gây trở ngại vận chuyển và lưu trữ; cần tiêm tăng cường miễn dịch (tiêm nhiều lần); có thể có tính sinh miễn dịch bảo vệ thấp; và tạo ra kháng thể chống lại axit nucleic.
3. Các loại vắc xin Covid-19 được WHO cấp phép sử dụng khẩn cấp hiện nay
3.1 Vắc xin toàn phần bất hoạt
- Vắc xin Sinopharm/BIBP (BBIBP-CorV, SARS-CoV-2 Vaccine (Vero Cell), Inactivated (lnCoV)) được nghiên cứu và sản xuất bởi Viện Nghiên cứu Sinh phẩm Bắc Kinh thuộc Sinopharm, Trung Quốc,
- Vắc xin Sinovac (Sinovac-CoronaVac, Covid-19 Vaccine (Vero Cell), Inactivated/ CoronavacTM) được phát triển bởi Sinovac, Tập đoàn Dược phẩm, Trung Quốc.
- Có hai loại vắc xin bất hoạt phòng Covid-19 khác đang trong quá trình xem xét là 1) Sinopharm/WIBP (WIBP-CorV, Inactivated SARS-CoV-2 Vaccine (Vero Cell)); 2) IMBCAMS (Institute of Medical Biology Chinese Academy of Medical Sciences, SARS-CoV-2 Vaccine, Inactivated (Vero Cell)).
3.2 Vắc xin vector
- Vắc xin AstraZeneca (Covid-19 Vaccine (ChAdOx1-S ([recombinant]) do đại học Oxford và hãng dược AstraZeneca (Anh) phát triển được ủy quyền và sản xuất trong đó được thương mại ở châu Âu là Vaxzevria/AZD1222 (EU Nodes-AstraZeneca/Oxford Covid-19 vaccine), ở Ấn độ là Covishield (Serum Institute of India Covid-19 vaccine) và ở Hàn quốc là AstraZeneca/SK BIO Covid-19.
- Vắc xin Janssen/Ad26.COV 2.S (Covid-19 Vaccine (Ad26.COV2-S [recombinant]) từ Công ty dược phẩm Janssen của Johnson & Johnson, Mỹ.
3.3 Vắc xin axit nucleic
- Vắc xin ARN Pfizer-BioNTech (Tozinameran-Covid-19 mRNA Vaccine COMIRNATY®) do Tập đoàn dược phẩm Pfizer, New York (Mỹ) và Công ty công nghệ sinh học BioNTech ở Mainz (Đức) phát triển.
- Vắc xin ARN Moderna (mARN-1273) do Công ty công nghệ sinh học Moderna, Inc. (Mỹ) phối hợp với Viện Dị ứng và Bệnh truyền nhiễm Quốc gia Mỹ (NIAID) phát triển.
Chi tiết các vắc xin phòng Covid-19 được WHO cấp phép và xem xét cấp phép được trình bày ở Bảng 1.
Bảng 1: Vắc xin phòng Covid-19 được Tổ chức Y tế Thế giới cấp phép và xem xét cấp phép
(Nguồn: https://covid-19pharmacovigilance.paho.org/; https://covid-19pharmacovigilance.paho.org/, https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html, http://www.healthdata.org/covid/covid-19-vaccine-efficacy-summary)
|
Tên Vắc xin (Nơi sản xuất) |
Đặc điểm |
Giai đoạn thử nghiệm lâm sàng |
Hiệu quả bảo vệ và hiệu quả chống biến chủng |
Liều tiêm và độ tuổi tiêm chủng |
Vị trí tiêm |
|
|
Tên thương mại |
Tên nghiên cứu |
|||||
|
Pfizer/ BioNtech (Đức/Mỹ) |
Tozinameran-Covid-19 mRNA Vaccine COMIRNATY® |
mARN mã hóa Glycoprotein được gói trong hạt lipid dưới dạng nano. |
- EUL* (WHO) 31/12/2020 - Anh, Brazil và nhiều nước châu Âu phê duyệt sử dụng đầu tiên; - 97 quốc gia phê duyệt và sử dụng; - 27 thử nghiệm trên 15 quốc gia; - FDA đã đồng ý cấp phép mở rộng độ tuổi tiêm chủng ở độ tuổi 12-15; - Nghiên cứu kết hợp 2 vắc xin Pfizer và AstraZeneca có kết quả khả thi, hiệu quả gấp 6 lần so với 2 mũi AstraZeneca. |
- Hiệu quả 91.3%; - Chống biến chủng: Alpha: 97% ở Israel, 92% ở Scotland, 93.7% ở Anh, 89% ở Canada; Beta: 85% ở Canada; Gamma: 85% ở Canada; Delta: 79% ở Scotland, 88% ở Anh, 85% ở Canada đối với bệnh nhân có triệu chứng. |
2 liều tiêm (cách nhau 21 ngày, 12 tuổi) |
Tiêm bắp |
|
Moderna Covid-19 (Mỹ) |
Moderna Covid-19 (mARN-1273, Elasomeran, Spikevax). |
mARN mã hóa Glycoprotein được gói trong hạt lipid dưới dạng nano. |
- EUL (WHO) 30/4/2021; - 69 quốc gia phê duyệt và sử dụng; - 25 thử nghiệm trên 6 quốc gia; - Được phê duyệt có hiệu quả khi mở rộng độ tuổi tiêm chủng 12-17. |
- Hiệu quả 94.1%; - Chống biến chủng: Alpha: 91% ở Canada, 100% ở Qatar, Beta: 96.4% ở Qatar đối với bệnh nhân có triệu chứng, kém hiệu quả hơn khi gặp biến chủng Gamma và Delta nhưng vẫn cung cấp khả năng bảo vệ đầy đủ và duy trì hiệu quả cao. |
2 liều tiêm (cách nhau 28 ngày) |
Tiêm bắp |
|
AstraZeneca (Vaxzevri-EU, Covishield- Ấn Độ, AstraZeneca/SK BIO) |
Covid-19 Vaccine (ChAdOx1-S, [recombinant]) |
Vector Adenovirus ChAdOx1 của loài tinh tinh mang đột biến Glycoprotein S của SARS-CoV-2. |
Vaxzevria/ AZD1222: EUL (WHO) 15/2/2021 Covishield: EUL (WHO) 15/2/2021 AstraZeneca/SK BIO Covid-19: EUL (WHO) 15/4/2021 - Anh, Argentina, Ấn Độ, Brazil phê duyệt sử dụng đầu tiên; - 121 quốc gia phê duyệt và sử dụng; - 39 thử nghiệm trên 20 quốc gia; - Một vài quốc gia ngừng tiêm do xuất hiện hiện tượng đông máu sau tiêm hiếm gặp; - Đang nghiên cứu loại vắc xin mới phù hợp với biến thể Beta dưới dạng khí dung (thuốc xịt mũi) tên AZD2816. |
- Hiệu quả 76%; - Chống biến chủng: Alpha: 74.6%, 74.5% ở Anh, 75% ở Canada, 73% ở Scotland Beta kém hiệu quả ở Nam Phi chỉ với 10.4%, Gamma đạt 57.6%, Delta 60% ở Scotland, 67% ở Anh đối với bệnh nhân có triệu chứng; - Chống nhập viện 71% sau mũi 1 và 92% sau mũi 2. |
2 liều tiêm (cách nhau 4-12 tuần) |
Tiêm bắp |
|
Johnson & Johnson’s Janssen (Mỹ) |
Janssen/ Ad26.COV 2.S, JNJ-78436735 |
Vector Adenovirus 26 mang đột biến Glycoprotein S của SARS-CoV-2. |
- EUL (WHO) 12/3/2021; - Bahrain, Mỹ, Nam Phi phê duyệt sử dụng đầu tiên; - 59 quốc gia phê duyệt và sử dụng; - 11 thử nghiệm trên 17 quốc gia; - Một vài quốc gia ngừng tiêm do xuất hiện hiện tượng đông máu sau tiêm hiếm gặp. |
- Hiệu quả Mỹ 72%, Brazil 68%, Nam Phi 64%; - Chống biến chủng Beta 64% ở Nam Phi, Gamma 68.1% ở Brazil đối với bệnh nhân có triệu chứng. |
1 liều tiêm (18 tuổi) |
Tiêm bắp |
|
Sinovac-CoronaVac (Trung Quốc) |
Sinovac-CoronaVac |
Chủng vi rút SARS-CoV-2 CZ02 nuôi trong Vero cells và bị bất hoạt, dùng chung với tá dược Aluminum hydroxide. |
- EUL (WHO) 1/6/2021; - Trung Quốc, Indonesia phê duyệt sử dụng đầu tiên; - 39 quốc gia phê duyệt và sử dụng; - 19 thử nghiệm trên 7 quốc gia; - Thiếu số liệu quy mô lớn trong thử nghiệm lâm sàng. |
- Hiệu quả: Brazil 50.65%, Thổ Nhĩ Kỳ 83.5%; - Chống biến chủng: Beta 70%, Gamma 50.3% ở Brazil đối với bệnh nhân có triệu chứng. - Trường hợp có triệu chứng giảm 80%, chống nhập viện 86% và tử vong 95%. |
2 liều tiêm (cách nhau 14-28 ngày, 18 tuổi) |
Tiêm bắp |
|
Sinopharm-BBIBP (Trung Quốc) |
BBIBP-CorV, SARS-CoV-2 Vaccine (Vero Cell), Inactivated (lnCoV)) |
Chủng vi rút SARS-CoV-2 9nCoV-CDC-Tan-HB02 (HB02) nuôi trong Vero cells và bị bất hoạt, dùng chung với tá dược Aluminum hydroxide |
- EUL (WHO) 7/5/2021; - Trung Quốc phê duyệt sử dụng đầu tiên; - 60 quốc gia phê duyệt và sử dụng; - 9 thử nghiệm trên 7 quốc gia. |
- Hiệu quả: 78,1%; - Chưa có dữ liệu về các biến chủng. |
2 liều tiêm (18 tuổi) |
Tiêm bắp |
*EUL (WHO): WHO Emergency Use Listing: Vaccine được đưa vào danh sách sử dụng khẩn cấp từ WHO
4. Các loại vắc xin đang được phát triển và thử nghiệm, vắc xin được cấp phép sử dụng khẩn cấp tại Việt Nam
Đến thời điểm hiện nay (04/8/2021), đã có 6 loại vaccine đã được Bộ Y tế phê duyệt cấp phép có điều kiện sử dụng tại Việt Nam bao gồm: Vắc xin mARN gồm Pfizer/BioNTech và Moderna mARN-1273, vắc xin vector vi rút gồm AstraZeneca, Janssen/Ad26.COV 2.S và Sputnik V và vắc xin vi rút bất hoạt toàn phần là Sinopharm BBIBP-CorV. Trong đó, Sputnik V (Gam-COVID-Vac) được nghiên cứu và phát triển tại Nga đang trong quá trình xem xét cấp phép từ WHO với hiệu quả bảo vệ 91.6% trong thử nghiệm giai đoạn 3.
Đồng thời, với sự phát triển nền khoa học, Việt Nam cũng đã và đang trong quá trình nghiên cứu và thử nghiệm vắc xin như Nanocovax, Covivac và ARCT-154 hứa hẹn mang đến hiệu quả cao trong quá trình thử nghiệm sắp tới. Nanocovax là vắc xin tiểu đơn vị protein được sản xuất bởi Công ty Cổ phần công nghệ sinh học dược Nanogen. Vắc xin Nanocovax trải qua 2 giai đoạn: giai đoạn 1 tháng 12/2020 và giai đoạn 2 tháng 2/2021, bước vào giai đoạn 3 với thử nghiệm trên 13.000 tình nguyện viên. Với vắc xin Covivac, vắc xin được nghiên cứu bằng công nghệ vector vi rút, tương tự với công nghệ vắc xin AstraZeneca (Anh) và Janssen/Ad26.COV 2.S (Mỹ) bởi viện IVAC, Việt Nam. Vắc xin này đang trong quá trình thử nghiệm lâm sàng giai đoạn 1 trên 120 tình nguyện viên và bước vào đầu giai đoạn 2 dưới sự quản lý của Bộ Y tế. Vắc xin ARCT-154 được sản xuất tại Việt Nam do Công ty Cổ phần Công nghệ sinh học VinBioCare thuộc Tập đoàn VinGroup đàm phán nhận chuyển giao công nghệ từ Công ty Arcturus Therapeutics, Inc, Hoa Kỳ. Vắc xin được áp dụng theo công nghệ tiên tiến saRNA, tương tự Pfizer và Moderna (Mỹ). Thử nghiệm được thực hiện lần lượt: giai đoạn 1 trên 100 người, giai đoạn 2 trên 300 người và giai đoạn 3 trên 20.600 người, đã được thực hiện tại Mỹ, Singapore và đang bắt đầu thử nghiệm tại Việt Nam. Giai đoạn 1 thử nghiệm lâm sàng dự kiến sẽ kết thúc trong 40 ngày kể từ ngày 15/8.
Chi tiết các vắc xin đang được nghiên cứu và thử nghiệm tại Việt nam được trình bày ở bảng 2.
Bảng 2: Các vắc xin đang được nghiên cứu và thử nghiệm tại Việt Nam
|
Tên vaccine |
Nơi sản xuất |
Đặc điểm |
Giai đoạn thử nghiệm lâm sàng |
|
Nanocovax |
Công ty Cổ phần công nghệ sinh học dược Nanogen |
Tiểu đơn vị protein S tái tổ hợp gắn trên giá thể là các hạt nano silica. |
- Giai đoạn 1 gồm độ tuổi từ 18-50 được phân vào 3 nhóm mức liều dùng là 25mcg, 50mcg và 75mcg - Giai đoạn 2 trên 560 người với độ tuổi mở rộng 18-60 được phần vào 4 nhóm với 3 mức liều dùng như trên và nhóm tiêm giả dược (Aluminum hydroxide). - Hiệu quả: Cả hai giai đoạn 1 và 2 không có tác dụng phụ nào nghiêm trọng và có khả năng kích hoạt các phản ứng kháng protein S mạnh mẽ. Nồng độ kháng thể IgG kháng protein S của cả 3 liều vắc xin tăng và cao nhất ở ngày thứ 42, cho thấy đáp ứng miễn dịch tốt và mạnh nhất ở ngày thứ 42. - Giai đoạn 3 trên 13.000 người, liều Nanocovax 25mcg đang được đề xuất nghiên cứu. |
|
Covivac |
Viện vắc xin và sinh phẩm y tế IVAC |
Protein S tái tổ hợp của vi rút SARS-CoV-2 biểu hiện trên bề mặt vi rút Newcastle (vi rút gây bệnh gà rù) và bất hoạt bằng beta propiolactone. |
- Giai đoạn 1 thực hiện trên 120 người được đánh giá đảm bảo an toàn, có tính sinh miễn dịch khả quan. - Giai đoạn 2 thực hiện trên 375 người, đang trong bước đầu thử nghiệm với 2 độ tuổi 18-59 và trên 60 ở mức liều dùng là 3mcg và 6mcg. Dự kiến tháng 11 có kết quả giữa kỳ thử nghiệm giai đoạn 2. |
|
ARCT-154 |
Sản xuất tại Việt Nam, chuyển giao công nghệ từ Công ty Arcturus Therapeutics, Inc, Hoa Kỳ, chịu trách nhiệm bởi Công ty Cổ phần Công nghệ sinh học VinBioCare thuộc Tập đoàn VinGroup. |
saRNA mã hóa Glycoprotein SARS-CoV-2. |
- Giai đoạn 1 thực hiện trên 100 người; - Giai đoạn 2 thực hiện trên 300 người; - Giai đoạn 3 thực hiện trên 20.600 người trong độ tuổi 18-59, đã qua khám sàng lọc không có tiền sử mắc các bệnh từ vi rút SARS, MERS hoặc SARS-CoV-2, chưa từng tiêm phòng Covid-19, không bệnh nền, không phải sử dụng bất kỳ loại thuốc nào thường xuyên. |
5. Kết luận
Vắc xin giúp bảo vệ cơ thể trước dịch bệnh Covid-19, giảm nguy cơ bệnh nặng hoặc tử vong khi mắc bệnh. Để được cấp phép sử dụng, các vắc xin đều phải trải qua 3 giai đoạn thử nghiệm lâm sàng với số lượng người tham gia thử nghiệm tăng dần theo mỗi giai đoạn, trên nguyên tắc đảm bảo 3 yếu tố: an toàn, sinh miễn dịch và hiệu quả bảo vệ khi sử dụng trong phòng chống bệnh. Hiện nay, trên thế giới đã có hơn 4.91 tỉ liều vắc xin được sử dụng với hơn 217 quốc gia và đạt 25% dân số toàn cầu được tiêm chủng. Theo đó là sự phát triển không ngừng của công nghệ chế tạo vắc xin cho ra đời nhiều ứng viên tiềm năng mới. Trước dịch bệnh Covid-19 đầy chuyển biến, đây là những con số đáng mong đợi, hướng đến mục tiêu đạt miễn dịch cộng đồng 60-70% trong tương lai. Tại Việt Nam, từ đầu năm 2021 đến nay, Bộ Y tế đã phê duyệt có điều kiện 6 loại vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh Covid-19. Song song đó cho ra đời những nghiên cứu mới và đang bước vào giai đoạn thử nghiệm lâm sàng ba loại vắc xin gồm Nanocovax (giai đoạn 3), Covivac (giai đoạn 2) và ARCT-154 (giai đoạn 1). Đây được xem là bước tiến dài của nền phát triển vắc xin tại Việt Nam trong bối cảnh gia tăng ca bệnh và tỷ lệ tử vong cao mỗi ngày gần đây. Tuy nhiên, nhiều nhà khoa học cảnh báo các nước không nên lơ là cảnh giác trong cuộc chiến với Covid-19, ngay cả khi tỷ lệ dân số tiêm chủng ngày càng tăng vì những biến đổi không lường trước của các biển thể mới.
Tài liệu tham khảo
-
- Alimoradi, M. (n.d.). COMPARISON OF COVID 19 VACCINES | Mya Care. MYACARE Health and Wellness Simplified. Retrieved July 20, 2021, from https://myacare.com/blog/comparison-of-covid-19-vaccines?fbclid=IwAR2a3MbVtVcZ91WbS_csxHqVba1eUojZ17KHIBWJMIWsb9YEnSVft5dObHg
- World Health Organization. (2021, 15 July) “Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process” Retrieved from https://extranet.who.int/pqweb/sites/default/files/documents/Status_COVID_VAX_15July2021.pdf
- Carl Zimmer, Jonathan Corum and Sui-Lee Wee. Coronavirus Vaccine Tracker [cited 2021, 2 August]; Available from: https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html
- Jonathan Corum and Carl Zimmer. How the Oxford-AstraZeneca Vaccine Works [cited 2021, 7 May]; Available from: https://www.nytimes.com/interactive/2020/health/oxford-astrazeneca-covid-19-vaccine.html
- Eva Thorne. Understanding the Covid-19 Variants of Concern. [cited 2021 18 June]; Available from: https://institute.global/policy/understanding-covid-19-variants-concern
- Sofia Moutinho. Chinese COVID-19 vaccine maintains protection in variant-plagued Brazil. [cited 2021 9 April]; Available from: https://www.sciencemag.org/news/2021/04/chinese-covid-19-vaccine-maintains-protection-variant-plagued-brazil
- Are Chinese COVID-19 shots effective against the Delta variant? [cited 2021 29 June]; Available from: https://www.reuters.com/world/china/are-chinese-covid-19-shots-effective-against-delta-variant-2021-06-29/
- Pharmaceutical Technology. (2021, 21 August) “Covid-19 Vaccination Tracker” Retrieved from: https://www.pharmaceutical-technology.com/covid-19-vaccination-tracker/
- COVID-19 vaccine efficacy summary [cited 2021 9 August]; Available from: http://www.healthdata.org/covid/covid-19-vaccine-efficacy-summary
- Vaccine COVIVAC được chấp thuận thử nghiệm lâm sàng giai đoạn 2 [cited 2021 9 August]; Available from: https://laodong.vn/y-te/vaccine-covivac-duoc-chap-thuan-thu-nghiem-lam-sang-giai-doan-2-939662.ldo
- Học viện Quân Y, viện Pasteur HCM, Công ty Cổ phần Công nghệ sinh học Dược Nanogen. “Kết quả thử nghiệm lâm sàng giai đoạn 1 và giai đoạn 2 của vắc xin Nanocovax do Công ty Cổ phần Công nghệ sinh học Dược Nanogen sản xuất (2021)” Retrieved from https://nanogenpharma.com/data/upload/files/KET%20QUA%20THU%20NGHIEM%20LAM%20SANG%20PHA%201%2C%202%20CUA%20NANOCOVAX.pdf
- Bộ Y tế. (2021, 15 August) “Vì sao ARCT-154 là vaccine được chuyển giao công nghệ vẫn phải thử nghiệm đủ 3 giai đoạn?” Retrieved from: https://ncov.moh.gov.vn/en/-/6847426-6850










Hãy là người bình luận đầu tiên