Lược dịch từ: “Advances in research on ACE2 as a receptor for 2019-nCoV”
Wu, J., Deng, W., Li, S. and Yang, X., 2021. Advances in research on ACE2 as a receptor for 2019-nCoV. Cellular and Molecular Life Sciences, 78(2), pp.531-544.
https://link.springer.com/article/10.1007/s00018-020-03611-x
Dịch giả:
BS Tăng Tuấn Ngạn
Trợ lý nghiên cứu, Học viên Cao học
Khoa Kỹ thuật Y Sinh, Trường Đại học Quốc tế, ĐHQG-HCM
PGS.TS Nguyễn Thị Hiệp
Khoa Kỹ thuật Y Sinh, Trường Đại học Quốc tế, ĐHQG-HCM
----------------
Giới thiệu
Enzyme chuyển angiotensin 2 (ACE2) lần đầu được phát hiện vào năm 20001,2. Trong đợt bùng dịch SARS năm 2003, ACE2 đã được xác định là một thụ thể trung gian cho sự xâm nhập của SARS-CoV vào tế bào chủ3,4. Một số nghiên cứu gần đây cho thấy 2019-nCoV cũng gây nhiễm vào tế bào chủ thông qua thụ thể ACE25-8. Theo đó, ACE2, với vai trò là thụ thể của 2019-nCoV, có thể là một mục tiêu điều trị tiềm năng cho COVID-19. Qua bài tổng quan, những tiến bộ mới nhất trong hiểu biết về vai trò của ACE2 liên quan đến 2019-nCoV sẽ được trình bày dưới góc nhìn sinh bệnh học COVID-19.
Đặc tính, vai trò sinh lý của ACE2 và hệ renin–angiotensin (RAS)
Enzyme chuyển angiotensin 2 (ACE2) – ban đầu được biết đến với tên “ACE homolog (ACEH)” hoặc “carboxypeptidase liên quan ACE” 1 – có trình tự chuỗi giống với ACE khoảng 40% và độ tương đồng đến 61%1. Gene ACE2 người định vị tại cánh ngắn NST X1, mã hoá ra ACE2 là một protein xuyên màng type I, có thể bị phân cắt bởi các protease như ADAM17 để giải phóng vùng phân tử nằm ở ngoại bào có hoạt tính peptidase vào dòng máu dưới dạng ACE2 hoà tan (sACE2)9,10
Hệ renin–angiotensin (RAS), phân bố trong hệ tuần hoàn và các mô cục bộ, là một trong những cơ chế nội tiết quan trọng để giữ thăng bằng nội môi với các vai trò điều hoà huyết áp, thể tích dịch, cân bằng natri-kali và có liên quan đến các bệnh tim mạch, đái tháo đường (ĐTĐ), v.v.11. RAS cổ điển bao gồm các phân tử hình thành nên trục ACE–Ang II–thụ thể AT1. ACE là một dicarboxypeptidase chuyển Ang I thành Ang II. Chất này gắn kết thụ thể angiotensin II type 1 (AT1) gây hiệu ứng co mạch, viêm và tăng sinh.
Phát kiến về ACE2 đã hé mở thêm con đường khác trong RAS ngoài con đường cổ điển: ACE2–Ang-(1-7)–thụ thể Mas12. ACE2, một monocarboxypeptidase, có vùng peptidase (PD) ở đầu tận N2. PD thuỷ phân Ang II thành Ang-(1-7), hoặc AngI thành Ang-(1-9) rồi lại bị thuỷ phân thành Ang-(1-7) bởi ACE và các enzyme khác. Ang-(1-7) gây ra các hiệu ứng trái ngược với Ang II (giãn mạch, kháng viêm và kháng tăng sinh) thông qua thụ thể Mas12. Trong thực tế, con đường chuyển hoá RAS không chỉ giới hạn bởi hai con đường kể trên12 (Hình 1).
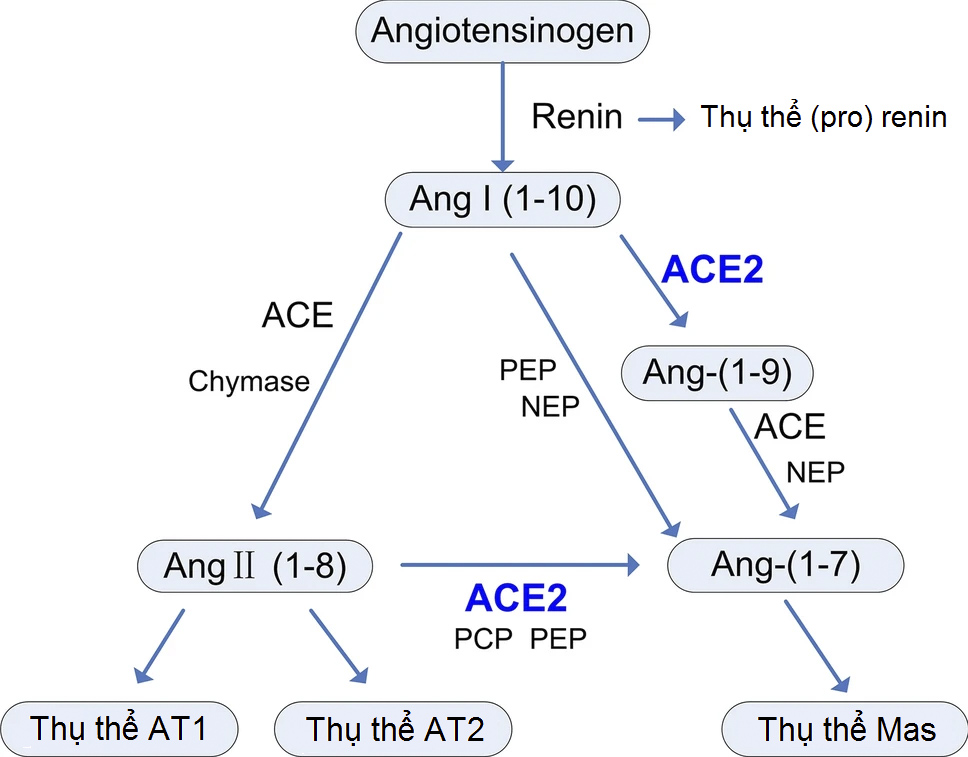
Hình 1. Các con đường chuyển hoá của hệ renin–angiotensin
Cấu trúc CoV và đặc tính của 2019-nCoV
CoV là một nhóm lớn các virus hình cầu, có bộ gene là mạch đơn RNA thuận có thể hoạt động như một mRNA được dịch mã trực tiếp thành protein trong ribosome tế bào chủ12. Đến nay, người ta biết được 7 type CoV gây nhiễm cho người. Trong đó, 3 type SARS-CoV, MERS-CoV và 2019-nCoV có độ lây truyền và tử vong cao14.
Các loại protein cấu trúc quan trọng của CoV bao gồm gai (S), vỏ bọc (E), màng (M) và nucleocapsid (N)15. Protein S tạo thành các trimer nhô trên lớp vỏ bọc, có tiểu đơn vị S1 chứa vùng gắn kết thụ thể (RBD) và tiểu đơn vị S2 điều hoà việc hoà màng16. Vì vậy, protein S chính là phần chủ chốt để xác định phạm vi vật chủ và khả năng lây truyền của CoV13.
Phân tích bộ gene cho thấy 2019-nCoV và SARS-CoV có độ tương đồng trình tự nucleotide đến 79.7%17,18. Khác biệt chủ yếu nằm ở khung đọc mở ORF1a và trình tự mã hoá protein S. Mặc dù trình tự RBD của protein S-2019-nCoV phần lớn được bảo tồn, nhiều vị trí amino acid quan trọng ảnh hưởng đến sự tương tác với ACE2 lại bị thay đổi8,9. Tuy vậy, cấu trúc 3D vùng RBD protein S của 2019-nCoV và SARS-CoV vẫn khá tương tự nhau, vì vậy cơ chế tương tác với ACE2 cũng giống nhau8.
ACE2 là thụ thể trung gian cho CoVs xâm nhập tế bào
Trong đợt bùng dịch SARS năm 2003, các thử nghiệm in vitro trên tế bào của Li và cs3 đã gợi ý ACE2 là thụ thể trung gian cho SARS-CoV xâm nhập tế bào chủ. Các thử nghiệm in vivo sau đó dùng chuột chuyển gene ACE2 người (hACE2) được gây nhiễm SARS-CoV đã giúp khẳng định điều trên20,22.
Với 2019-nCoV, người ta cũng đã gây nhiễm thành công ở nhiều loại tế bào vốn không nhạy cảm với virus như tế bào HeLa5 và BHK-2123 bằng cách tạo biểu hiện ACE2. Tương tự như vậy, trong một thí nghiệm dùng chuột chuyển gene người và cho gây nhiễm với 2019-nCoV, người ta đã tìm thấy kháng nguyên virus ở tế bào của mô có biểu hiện hACE2, trong khi nhóm chứng chuột hoang dã thì không có24.
Ái lực gắn kết ACE2 là một trong những yếu tố quyết định tính truyền nhiễm của SARS-CoV7. Phân tích cấu trúc cho thấy 2019-nCoV-RBD thâm nhập sâu vào túi kỵ nước của ACE225, giúp cho sự gắn kết mạnh hơn SARS-CoV gấp 10–20 lần26.
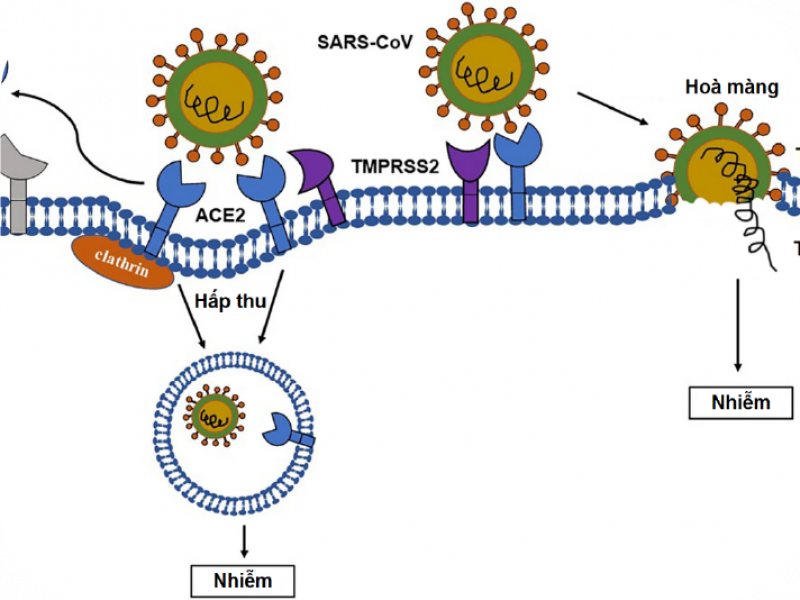
Đóng vai trò như một thụ thể, ACE2 làm trung gian cho virus xâm nhập tế bào thông qua hai cách khác nhau (Hình 2).
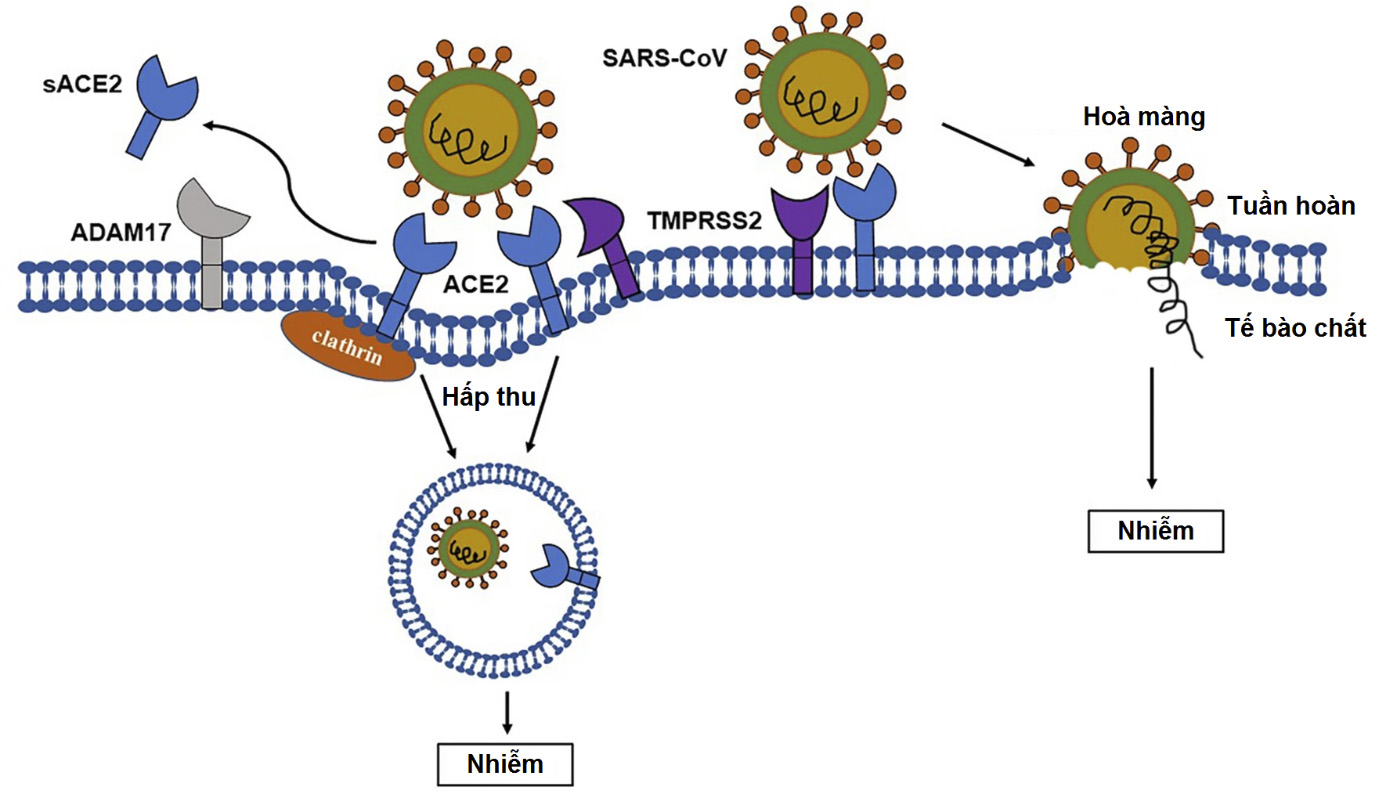
Hình 2. Quá trình xâm nhập tế bào của virus thông qua thụ thể ACE2.
Cách thứ nhất liên quan đến sự nhập bào phụ thuộc clathrin. RBD virus được nhận diện bởi PD ngoại bào của ACE2 qua các gốc phân cực. Khi CoV kết nối ACE2, vùng ngoại bào của ACE2 có hoạt tính xúc tác bị một số protease (như ADAM17) phân cắt, còn vùng xuyên màng thì được nội bào hoá. Tiếp theo, nhờ clathrin27, các hạt virus được nhập bào cùng cấu trúc nội bào của ACE2. Mặc dù vai trò sinh lý của phần ACE2 li khai ngoại bào chưa được hiểu rõ, nó đã được chứng minh là ảnh hưởng sự xâm nhập và nhân bản virus3,28,29. Tuy nhiên, có vẻ điều này không liên quan đến hoạt tính enzyme của sACE2, vì trong một nghiên cứu, các tế bào biểu hiện ACE2 đột biến mất hoạt tính vẫn có thể bị nhiễm SARS-CoV30. Phân tích cấu trúc ACE2–PD cũng cho thấy protein S-CoV không tương tác vị trí hoạt động peptidase trong ACE231.
Cách thứ hai liên quan đến sự hoà màng qua trung gian thụ thể ACE2 phụ thuộc protease xuyên màng serine 2 (TMPRSS2)23,32. Khi protein S gắn kết ACE2, TMPRSS2 xử lý để giúp virion hoà màng trực tiếp hoặc được hấp thu qua túi nhập bào. Cơ chế phân tử của quá trình xâm nhập tế bào nhờ sự phân cắt ACE2 của protease vẫn chưa sáng tỏ hoàn toàn, dù một số yếu tố cần thiết cho quá trình nhập báo đã được chứng minh32,33.
Ngoài ra, ACE2 được phát hiện là hỗ trợ cho sự biểu hiện bề mặt của amino acid transporter B0AT1, một tác nhân trung gian hấp thu amino acid trung tính vào tế bào ruột. B0AT1 có thể ngăn chặn TMPRSS2 tiếp cận tiếp diện phân cắt ACE2; tuy nhiên điều này có làm ức chế sự nhiễm 2019-nCoV hay không vẫn còn là một câu hỏi chưa được khẳng định34.
Thay đổi biểu hiện ACE2 sau khi gắn kết với CoV
Một số nghiên cứu đã gợi ý rằng biểu hiện ACE2 cũng như hiệu ứng bảo vệ của nó bị suy giảm sau khi nhiễm SARS-CoV và đây có thể là cơ chế sinh lý bệnh tiềm ẩn cho các biến chứng phổi và tim mạch liên quan đến SARS4,35,36. Tương tự đối với 2019-nCoV, protein S của virus tương tác với ACE2 trên bề mặt tế bào chủ và được nhập bào cùng với ACE2, dẫn đến giảm biểu lộ ACE2 bề mặt37,38. Sự nhập bào còn làm tăng hoạt tính ADAM17, đến lượt enzyme này tiếp tục phân cắt ACE2 trên bề mặt màng43, ngoài ra còn gây phóng thích tiền chất liên kết màng của các cytokine tiền viêm vào máu29, làm giảm sút trầm trọng hơn hiệu ứng bảo vệ của RAS ở mô. Giảm sút ACE2 dẫn đến mất cân bằng RAS, làm tăng Ang II, gây tổn thương cơ quan thông qua thụ thể AT1, trong khi đó sự tăng hoạt ADAM17 trong vòng xoắn phản hồi dương tính càng phân cắt nhiều ACE2 trên bề mặt tế bào hơn37 (Hình 3). Nồng độ Ang II huyết tương được báo cáo là tăng cao rõ rệt ở người bị nhiễm 2019-nCoV so với người không nhiễm và có tương quan tuyến tính với tải lượng virus và mức độ tổn thương phổi39.
Dựa theo những kết quả trên, các nhà nghiên cứu đề xuất ra các chiến lược điều trị COVID-19 với mục tiêu nhắm vào ACE2, bao gồm việc dùng chất ức chế TMPRSS223,40, dùng kháng thể hoặc peptide để chẹn thụ thể ACE2, hoặc dùng sACE2 để giảm sự xâm nhập của virus qua cơ chế cạnh tranh gắn kết, từ đó ngăn ngừa tổn thương phổi thông qua các đặc tính enzym độc đáo của nó40. Nghiên cứu in vitro cho thấy các chất ức chế ADAM17 có thể làm giảm sự nhân bản virus28. ACE2 hoà tan của người tái tổ hợp (rhACE2) có thể ngăn ngừa 2019-nCoV nhiễm vào các mô hình giả mạch máu và thận được thiết kế bằng tế bào gốc vạn năng cảm ứng, và rhACE2 cũng không biểu hiện gây độc tế bào41. Tuy nhiên, rhACE2 chỉ mới được chứng minh khả năng ngăn chặn nhiễm 2019-nCoV giai đoạn sớm, cần có thêm các bằng chứng lâm sàng để khẳng định về hiệu quả điều trị.
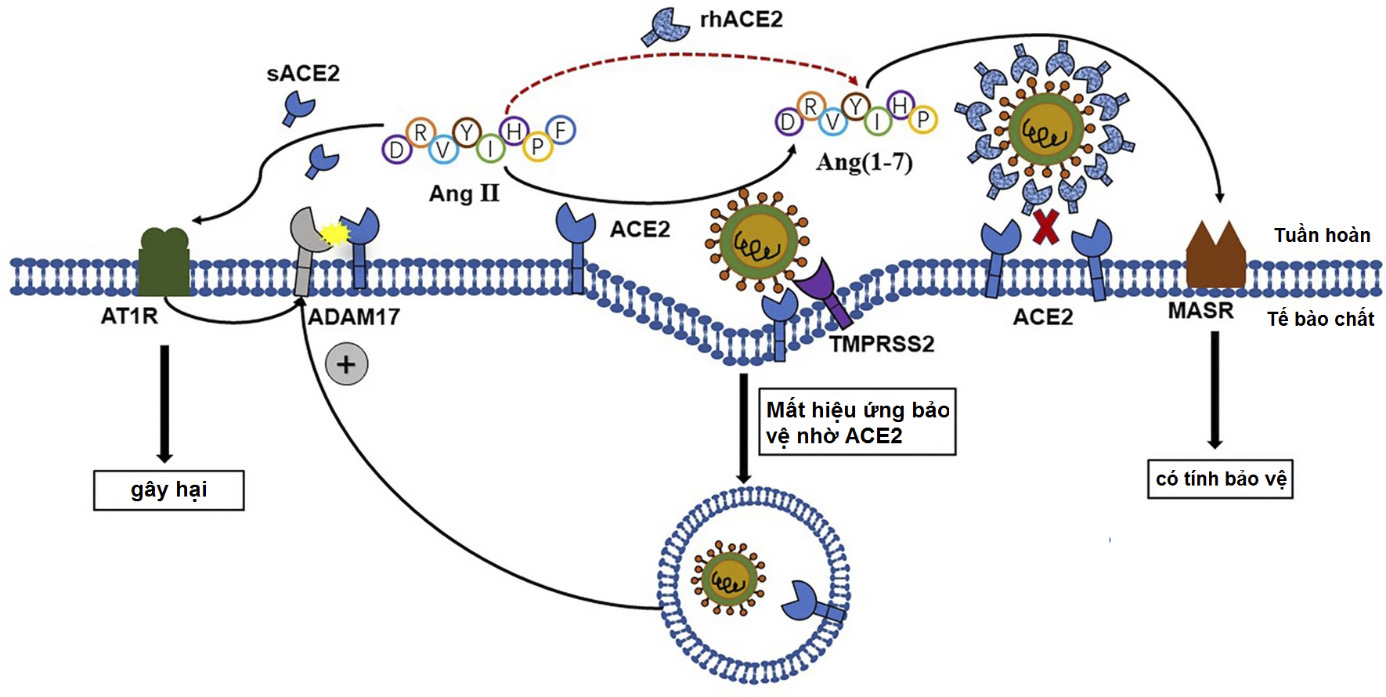
Hình 3. Các cơ chế làm giảm biểu hiện ACE2 bề mặt tế bào do 2019-nCoV.
Mặt khác, một số nhà nghiên cứu lại có quan điểm trái ngược, cho rằng nhiễm virus làm tăng biểu hiện ACE2. Một nhóm nghiên cứu ở Trung Quốc đã chứng minh rằng ACE2 có thể tăng biểu hiện bởi kích thích từ virus hoặc cytokine viêm42. Kích hoạt hệ miễn dịch do nhiễm virus gây ra sự biểu hiện của một loạt cytokines (“cơn bão cytokine”), chúng thúc đẩy phiên mã và biểu hiện ACE2 thông qua các con đường dẫn truyền tín hiệu xuôi dòng. Qua đó có thể thấy, “cơn bão cytokine” do 2019-nCoV không chỉ tổn hại mô chủ mà còn thúc đẩy thêm sự lan truyền virus thông qua sự tăng biểu hiện ACE2 – vốn là đáp ứng bảo vệ mô42,43.
Tóm lại, thay đổi biểu hiện ACE2 và cơ chế điều hoà nó sau gắn kết protein S-CoV vẫn chưa sáng tỏ. Tuy nhiên, dù là tăng hay giảm hoạt ACE2 cũng dẫn đến những hậu quả có hại cho cơ thể. Có thể trong giai đoạn tế bào chống lại virus, biểu hiện ACE2 liên tục thay đổi (lên hoặc xuống), và mặc dù hoạt động miễn dịch đặc biệt quan trọng trong giai đoạn này, chỉ trường hợp miễn dịch hoạt động hợp lý mới có thể đánh bại virus (Hình 4).
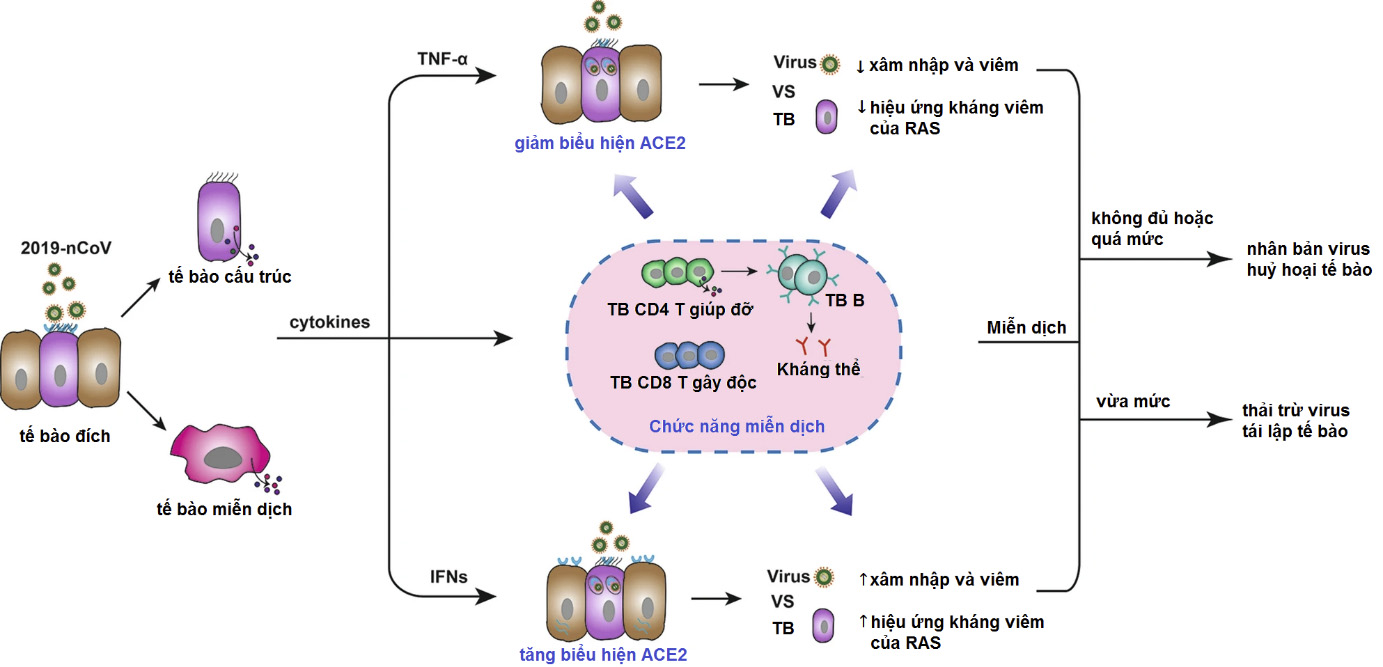
Hình 4. Thay đổi biểu hiện ACE2 và vai trò của miễn dịch sau khi nhiễm 2019-nCoV.
Biểu hiện ACE2 ở các cơ quan khác nhau và các con đường lây truyền virus
Mức độ và xu hướng biểu hiện ACE2 ở các mô khác nhau có thể quan trọng đối với tính cảm nhiễm, biểu hiện triệu chứng và kết cục của bệnh COVID-19. Do đó, việc khám phá ra đặc tính biểu hiện ACE2 ở các mô và mối quan hệ của nó đối với sự lây truyền virus là tối quan trọng để hiểu được sinh bệnh học và điều trị cho COVID-19.
ACE2 được tìm thấy nhiều ở tim (tế bào nội mô mạch vành, cơ trơn mạch máu, cơ tim, v.v.), thận (tế bào mạch máu thận và biểu mô ống thận) và tinh hoàn. Nó còn biểu hiện ở ống tiêu hoá và phổi – hai nơi cung cấp lối xâm nhập cho SARS-CoV1,44. Tuy nhiên, mức độ biểu hiện ở phổi bình thường lại không cao, gợi ý có thể một số tế bào có thể tăng biểu hiện ở điều kiện nhất định25. Các nghiên cứu gần đây tiết lộ rằng ACE2 và TMPRSS2 còn biểu hiện ở bề mặt mắt và biểu mô mũi, những cổng lây nhiễm tiềm năng cho 2019-nCoV45,46.
ACE2 được ghi nhận biểu hiện nhiều ở tế bào biểu mô thực quản, hồi tràng và đại tràng, phù hợp với khả năng lây truyền qua đường phân–miệng của 2019-nCoV25,47. Kết quả nghiên cứu trên mô hình giả đường mật gan48 cho thấy 2019-nCoV có thể gây nhiễm tế bào đường mật biểu hiện ACE2, dẫn đến suy giảm chức năng hàng rào bảo vệ và vận chuyển acid mật. Đây có thể là cơ chế góp phần dẫn đến tổn thương và suy giảm chức năng gan ở bệnh nhân COVID-19, ngoài nguyên nhân phản ứng viêm toàn thân48.
Tổn thương thận cấp cũng được ghi nhận ở bệnh nhân COVID-1949. Ngoài ra, do đáp ứng miễn dịch, tổn thương thận có thể do virus tấn công trực tiếp vào các tế bào đích biểu hiện ACE2 ở thận, gây độc tế bào và làm rối loạn chức năng thận50,51. Tinh hoàn cũng là nơi biểu hiện ACE2 cao, chủ yếu ở tinh nguyên bào, tế bào Sertoli và tế bào mô kẽ. Mặc dù chưa có nghiên cứu khảo sát về khả năng bị tổn thương tinh hoàn do nhiễm 2019-nCoV, một số chuyên gia nhấn mạnh việc đánh giá chức năng sinh sản ở những bệnh nhân nam hồi phục sau nhiễm51.
Người ta đã báo cáo sự có mặt của 2019-nCoV trong máu bệnh nhân COVID-19, gợi ý đôi khi xảy ra tình trạng nhiễm hệ thống52. Trong khi tại phổi bình thường, hơn 80% ACE2 phân bố ở tế bào phế nang type II53, thì phân tích mô phổi xơ hoá – một hậu quả thường gặp của bệnh nhân SARS và COVID-19 – cho thấy ACE2 biểu hiện chủ yếu ở tế bào động mạch54. Điểm đến đầu tiên của dòng tuần hoàn phổi là tim, mà người bị suy tim lại tăng biểu hiện ACE2 ở cơ tim54. Vì vậy, người ta đặt giả thuyết 2019-nCoV có thể tấn công tim qua dòng máu, điều này lý giải cho tỉ lệ tổn thương tim cao ở những ca bệnh nặng54,55. Tỉ lệ có biến chứng huyết khối ở bệnh nhân COVID-19 tại ICU là 31%, một con số rất cao56. Nhìn chung, sự hiện diện 2019-nCoV trong dòng tuần hoàn là bước quan trọng để nó lây truyền cho các cơ quan, thể dịch và chất bài tiết, cũng như tạo ra con đường lây nhiễm qua máu.
Biểu hiện ACE2 ở các quần thể khác nhau và tính nhạy cảm đối với 2019-nCoV
Việc tìm hiểu tính nhạy cảm với 2019-nCoV ở các quần thể khác nhau qua phân tích biểu hiện ACE2 có thể cung cấp những thông tin quý giá cho việc phòng chống dịch bệnh hiệu quả và kịp thời. Nghiên cứu phân tích mô phổi bình thường đã nhận thấy không có sự khác biệt rõ rệt về biểu hiện gene ACE2 ở các chủng tộc, độ tuổi, giới tính; trong khi ở người HTL, biểu hiện gene ACE2 lại cao hơn57,58. Trong biểu mô phế quản, loại tế bào có biểu hiện cao ACE2 ở người HTL là tế bào đài, trong khi ở người không HTL là tế bào clara58.
Nghiên cứu so sánh đặc tính bộ gene của ACE2 ở các quần thể khác nhau cho thấy biểu hiện ACE2 có thể khác nhau giữa các nhóm và chủng tộc châu Á59. Tuy nhiên, chưa tìm thấy sự tồn tại của đột biến ACE2 nào có thể chống lại sự gắn kết với protein S-CoV59. Có thể tính đa hình di truyền của ACE2 chỉ gây ảnh hưởng biên đến ái tính của nó với 2019-nCoV-RBD60.
Các nghiên cứu đặc điểm dịch tễ COVID-19 báo cáo rằng bệnh nhân COVID-19 có bệnh nền mạn tính như tăng huyết áp (THA), ĐTĐ, COPD, bệnh mạch vành sẽ có xu hướng bị nặng hơn61-63. Điều này phù hợp với các ghi nhận rằng nồng độ ACE2 huyết thanh tăng cao có ý nghĩa ở bệnh nhân có THA64, suy tim65 và các bệnh kèm theo khác66. Qua đó gợi ý rằng bệnh nền có khả năng gây tình trạng mất thăng bằng RAS, làm suy yếu miễn dịch và tăng nhạy cảm với 2019-nCoV. Do đó, cần chú ý nhiều hơn đến nhóm dân số này để giảm nguy cơ lây nhiễm và độ nặng của bệnh.
Kết luận
2019-nCoV, cũng giống như SARS-CoV, xâm nhập tế bào chủ qua thụ thể ACE2. Nhiều học giả đã chú ý đến việc ACE2 biểu hiện rộng rãi ở nhiều cơ quan nhưng lại không nhiều ở phổi, dù đây là cơ quan nhiễm bệnh chính67. Điều này dẫn đến câu hỏi, có thụ thể nào khác ngoài ACE2 làm trung gian cho sự xâm nhập 2019-nCoV vào tế bào chủ không? Một nghiên cứu đã cho thấy thụ thể Ang II type 2 (AT2) – một thành phần đối kháng AT1 trong RAS, biểu hiện rất nhiều ở mô phổi, có thể là một thụ thể khác cho 2019-nCoV67. Giả thuyết này vẫn cần có nhiều khảo sát hơn để khẳng định. Bên cạnh đó, cơ chế tương tác qua lại giữa hệ miễn dịch và RAS trong bệnh cảnh “cơn bão cytokine” do nhiễm 2019-nCoV vẫn còn là câu hỏi cần được giải quyết cấp bách68,69.
Thực tế, ACE2 đóng vai trò kép trong bệnh COVID-19, đầu tiên là thụ thể cho 2019-nCoV, tiếp theo lại là phân tử có tính bảo vệ trong RAS. ACE2 là bạn hay là thù đối với con người trong bệnh cảnh nhiễm 2019-nCoV, điều này vẫn chưa được sáng tỏ. Bài tổng quan này tóm tắt những cập nhật nghiên cứu về ACE2 trong bệnh COVID-19. Hy vọng rằng những thông tin này sẽ giúp độc giả hình dung rõ hơn bức tranh về cơ chế bệnh sinh của 2019-nCoV, cũng như có thể tham khảo cho việc dùng ACE2 như mục tiêu điều trị tiềm năng cho COVID-19.
Tài liệu tham khảo
1. Tipnis, S. R. et al. A Human Homolog of Angiotensin-converting Enzyme: CLONING AND FUNCTIONAL EXPRESSION AS A CAPTOPRIL-INSENSITIVE CARBOXYPEPTIDASE *. J. Biol. Chem. 275, 33238–33243 (2000).
2. Donoghue, M. et al. A Novel Angiotensin-Converting Enzyme–Related Carboxypeptidase (ACE2) Converts Angiotensin I to Angiotensin 1-9. Circ. Res. 87, e1–e9 (2000).
3. Li, W. et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 426, 450–454 (2003).
4. Kuba, K. et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus–induced lung injury. Nat. Med. 11, 875–879 (2005).
5. Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273 (2020).
6. Lu, R. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. The Lancet 395, 565–574 (2020).
7. Wan, Y., Shang, J., Graham, R., Baric, R. S. & Li, F. Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade-Long Structural Studies of SARS Coronavirus. J. Virol. 94, e00127-20.
8. Xu, X. et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci. China Life Sci. 63, 457–460 (2020).
9. Guy, J. L., Lambert, D. W., Turner, A. J. & Porter, K. E. Functional angiotensin-converting enzyme 2 is expressed in human cardiac myofibroblasts. Exp. Physiol. 93, 579–588 (2008).
10. Lambert, D. W. et al. Tumor Necrosis Factor-α Convertase (ADAM17) Mediates Regulated Ectodomain Shedding of the Severe-acute Respiratory Syndrome-Coronavirus (SARS-CoV) Receptor, Angiotensin-converting Enzyme-2 (ACE2) *. J. Biol. Chem. 280, 30113–30119 (2005).
11. Paul, M., Poyan Mehr, A. & Kreutz, R. Physiology of Local Renin-Angiotensin Systems. Physiol. Rev. 86, 747–803 (2006).
12. Santos, R. A. S. et al. The ACE2/Angiotensin-(1–7)/MAS Axis of the Renin-Angiotensin System: Focus on Angiotensin-(1–7). Physiol. Rev. 98, 505–553 (2018).
13. Hulswit, R. J. G., de Haan, C. A. M. & Bosch, B.-J. Chapter Two - Coronavirus Spike Protein and Tropism Changes. in Advances in Virus Research (ed. Ziebuhr, J.) vol. 96 29–57 (Academic Press, 2016).
14. Zhu, N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N. Engl. J. Med. (2020) doi:10.1056/NEJMoa2001017.
15. Chen, Y., Liu, Q. & Guo, D. Emerging coronaviruses: Genome structure, replication, and pathogenesis. J. Med. Virol. 92, 418–423 (2020).
16. Li, F. Evidence for a Common Evolutionary Origin of Coronavirus Spike Protein Receptor-Binding Subunits. J. Virol. 86, 2856–2858 (2012).
17. Wu, A. et al. Genome Composition and Divergence of the Novel Coronavirus (2019-nCoV) Originating in China. Cell Host Microbe 27, 325–328 (2020).
18. Zhou, Y. et al. Network-based drug repurposing for novel coronavirus 2019-nCoV/SARS-CoV-2. Cell Discov. 6, 1–18 (2020).
19. Li, F., Li, W., Farzan, M. & Harrison, S. C. Structure of SARS Coronavirus Spike Receptor-Binding Domain Complexed with Receptor. Science 309, 1864–1868 (2005).
20. Tseng, C.-T. K. et al. Severe Acute Respiratory Syndrome Coronavirus Infection of Mice Transgenic for the Human Angiotensin-Converting Enzyme 2 Virus Receptor. J. Virol. 81, 1162–1173 (2007).
21. McCray, P. B. et al. Lethal Infection of K18-hACE2 Mice Infected with Severe Acute Respiratory Syndrome Coronavirus. J. Virol. 81, 813–821 (2007).
22. Yang, X. et al. Mice Transgenic for Human Angiotensin-converting Enzyme 2 Provide a Model for SARS Coronavirus Infection. Comp. Med. 57, 450–459 (2007).
23. Hoffmann, M. et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 181, 271-280.e8 (2020).
24. Bao, L. et al. The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice. Nature 583, 830–833 (2020).
25. Chen, Y., Guo, Y., Pan, Y. & Zhao, Z. J. Structure analysis of the receptor binding of 2019-nCoV. Biochem. Biophys. Res. Commun. 525, 135–140 (2020).
26. Wrapp, D. et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 367, 1260–1263 (2020).
27. Wang, H. et al. SARS coronavirus entry into host cells through a novel clathrin- and caveolae-independent endocytic pathway. Cell Res. 18, 290–301 (2008).
28. Haga, S. et al. TACE antagonists blocking ACE2 shedding caused by the spike protein of SARS-CoV are candidate antiviral compounds. Antiviral Res. 85, 551–555 (2010).
29. Haga, S. et al. Modulation of TNF-α-converting enzyme by the spike protein of SARS-CoV and ACE2 induces TNF-α production and facilitates viral entry. Proc. Natl. Acad. Sci. 105, 7809–7814 (2008).
30. Moore, M. J. et al. Retroviruses Pseudotyped with the Severe Acute Respiratory Syndrome Coronavirus Spike Protein Efficiently Infect Cells Expressing Angiotensin-Converting Enzyme 2. J. Virol. 78, 10628–10635 (2004).
31. Towler, P. et al. ACE2 X-Ray Structures Reveal a Large Hinge-bending Motion Important for Inhibitor Binding and Catalysis *. J. Biol. Chem. 279, 17996–18007 (2004).
32. Heurich, A. et al. TMPRSS2 and ADAM17 Cleave ACE2 Differentially and Only Proteolysis by TMPRSS2 Augments Entry Driven by the Severe Acute Respiratory Syndrome Coronavirus Spike Protein. J. Virol. 88, 1293–1307 (2014).
33. Ou, X. et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nat. Commun. 11, 1620 (2020).
34. Yan, R. et al. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science 367, 1444–1448 (2020).
35. Imai, Y. et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 436, 112–116 (2005).
36. Oudit, G. Y. et al. SARS-coronavirus modulation of myocardial ACE2 expression and inflammation in patients with SARS. Eur. J. Clin. Invest. 39, 618–625 (2009).
37. Wang, K., Gheblawi, M. & Oudit, G. Y. Angiotensin Converting Enzyme 2. Circulation 142, 426–428 (2020).
38. Wang, S. et al. Endocytosis of the receptor-binding domain of SARS-CoV spike protein together with virus receptor ACE2. Virus Res. 136, 8–15 (2008).
39. Liu, Y. et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci. China Life Sci. 63, 364–374 (2020).
40. Zhang, H., Penninger, J. M., Li, Y., Zhong, N. & Slutsky, A. S. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 46, 586–590 (2020).
41. Monteil, V. et al. Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2. Cell 181, 905-913.e7 (2020).
42. Zhuang, M.-W. et al. Increasing host cellular receptor—angiotensin-converting enzyme 2 expression by coronavirus may facilitate 2019-nCoV (or SARS-CoV-2) infection. J. Med. Virol. 92, 2693–2701 (2020).
43. Ziegler, C. G. K. et al. SARS-CoV-2 Receptor ACE2 Is an Interferon-Stimulated Gene in Human Airway Epithelial Cells and Is Detected in Specific Cell Subsets across Tissues. Cell 181, 1016-1035.e19 (2020).
44. Danilczyk, U. & Penninger, J. M. Angiotensin-Converting Enzyme II in the Heart and the Kidney. Circ. Res. 98, 463–471 (2006).
45. Zhou, L. et al. ACE2 and TMPRSS2 are expressed on the human ocular surface, suggesting susceptibility to SARS-CoV-2 infection. Ocul. Surf. 18, 537–544 (2020).
46. Sungnak, W. et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat. Med. 26, 681–687 (2020).
47. Zhang, H. et al. The digestive system is a potential route of 2019-nCov infection: a bioinformatics analysis based on single-cell transcriptomes. bioRxiv 2020.01.30.927806 (2020) doi:10.1101/2020.01.30.927806.
48. Zhao, B. et al. Recapitulation of SARS-CoV-2 infection and cholangiocyte damage with human liver ductal organoids. Protein Cell 11, 771–775 (2020).
49. Li, Z. et al. Caution on Kidney Dysfunctions of COVID-19 Patients. medRxiv 2020.02.08.20021212 (2020) doi:10.1101/2020.02.08.20021212.
50. Lin, W. et al. Single-cell Analysis of ACE2 Expression in Human Kidneys and Bladders Reveals a Potential Route of 2019-nCoV Infection. bioRxiv 2020.02.08.939892 (2020) doi:10.1101/2020.02.08.939892.
51. Fan, C., Li, K., Ding, Y., Lu, W. & Wang, J. ACE2 Expression in Kidney and Testis May Cause Kidney and Testis Damage After 2019-nCoV Infection. medRxiv 2020.02.12.20022418 (2020) doi:10.1101/2020.02.12.20022418.
52. Wang, W. et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA (2020) doi:10.1001/jama.2020.3786.
53. Zhao, Y. et al. Single-Cell RNA Expression Profiling of ACE2, the Receptor of SARS-CoV-2. Am. J. Respir. Crit. Care Med. 202, 756–759 (2020).
54. Guo, J. et al. Single-cell RNA analysis on ACE2 expression provides insights into SARS-CoV-2 potential entry into the bloodstream and heart injury. J. Cell. Physiol. 235, 9884–9894 (2020).
55. Wang, D. et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA 323, 1061 (2020).
56. Klok, F. A. et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb. Res. 191, 145–147 (2020).
57. Cai, G., Bossé, Y., Xiao, F., Kheradmand, F. & Amos, C. I. Tobacco Smoking Increases the Lung Gene Expression of ACE2, the Receptor of SARS-CoV-2. Am. J. Respir. Crit. Care Med. 201, 1557–1559 (2020).
58. Cai, G. Bulk and single-cell transcriptomics identify tobacco-use disparity in lung gene expression of ACE2, the receptor of 2019-nCov. medRxiv 2020.02.05.20020107 (2020) doi:10.1101/2020.02.05.20020107.
59. Cao, Y. et al. Comparative genetic analysis of the novel coronavirus (2019-nCoV/SARS-CoV-2) receptor ACE2 in different populations. Cell Discov. 6, 1–4 (2020).
60. Othman, H. et al. Interaction of the spike protein RBD from SARS-CoV-2 with ACE2: Similarity with SARS-CoV, hot-spot analysis and effect of the receptor polymorphism. Biochem. Biophys. Res. Commun. 527, 702–708 (2020).
61. Zhou, F. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet 395, 1054–1062 (2020).
62. Guan, W. et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N. Engl. J. Med. (2020) doi:10.1056/NEJMoa2002032.
63. Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet 395, 507–513 (2020).
64. Li, S. et al. Association between circulating angiotensin-converting enzyme 2 and cardiac remodeling in hypertensive patients. Peptides 90, 63–68 (2017).
65. Chen, L., Li, X., Chen, M., Feng, Y. & Xiong, C. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc. Res. 116, 1097–1100 (2020).
66. Pinto, B. G. G. et al. ACE2 Expression Is Increased in the Lungs of Patients With Comorbidities Associated With Severe COVID-19. J. Infect. Dis. 222, 556–563 (2020).
67. Cui, Q. et al. AGTR2, One Possible Novel Key Gene for the Entry of 2019-nCoV into Human Cells. (2020) doi:10.20944/preprints202002.0194.v1.
68. Feng, Z. et al. The Novel Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Directly Decimates Human Spleens and Lymph Nodes. medRxiv 2020.03.27.20045427 (2020) doi:10.1101/2020.03.27.20045427.
69. Li, H. et al. SARS-CoV-2 and viral sepsis: observations and hypotheses. The Lancet 395, 1517–1520 (2020).









Hãy là người bình luận đầu tiên