Vaccine dạng hít và tiềm năng phát triển trong kỷ nguyên COVID-19
Đỗ Bá Quốc Thái, Nhóm nghiên cứu Y sinh học GMIF, Khoa Sinh học-Công nghệ Sinh học, Trường Đại học Khoa học Tự nhiên, ĐHQG-HCM
PGS.TS Trần Văn Hiếu, Nhóm nghiên cứu Y sinh học GMIF; PTN. Cảm biến sinh học, Khoa Sinh học-Công nghệ Sinh học, Trường Đại học Khoa học Tự nhiên, ĐHQG-HCM
---------
Trong bối cảnh chưa có thuốc chữa trị đặc hiệu, vaccine hiện đang là phương pháp hiệu quả nhất trong việc bảo vệ con người khỏi sự xâm nhiễm của virus SARS-CoV-2. Tuy nhiên, nhiều quốc gia tiến hành chủng ngừa toàn diện vẫn gặp tình trạng tái nhiễm trong cộng đồng [1], dẫn đến việc phải liên tục “mở cửa” và “đóng cửa” xã hội, gây nên nhiều thiệt hại về kinh tế. Bên cạnh đó, nhiều biến chủng của SARS-CoV được hình thành dần trở thành một vấn đề gây chú ý [2]. Vậy, vaccine dạng hít đang nhận được nhiều sự chú ý trong giới nghiên cứu khoa học có thực sự là giải pháp lâu dài trong kỷ nguyên COVID-19 hay không?
Tại sao chúng ta cần vaccine dạng hít (khí dung)?
Sự cần thiết của vaccine dạng hít có thể được làm rõ khi so sánh chúng với vaccine dạng tiêm truyền thống. Đối với vaccine tiêm truyền thống, việc chủ động gây đáp ứng miễn dịch trên cơ thể người giúp hệ miễn dịch người chuẩn bị tốt cho sự xâm nhiễm trong tương lai. Hiện nay, mục tiêu chính của hầu hết các vaccine COVID-19 là giúp cơ thể tạo ra kháng thể có khả năng trung hòa và ngăn cản sự tăng sinh của virus trong cơ thể [3]. Các vaccine hiện có, nhìn chung, là sự mô phỏng lại một phần hoặc toàn bộ cấu trúc kháng nguyên của virus SARS-CoV-2. Chúng gây đáp ứng miễn dịch trong cơ thể thông qua việc nhận biết của các tế bào trình diện kháng nguyên, qua đó hoạt hóa các tế bào miễn dịch trong cơ thể sản xuất kháng thể để chống lại virus (Hình 1).
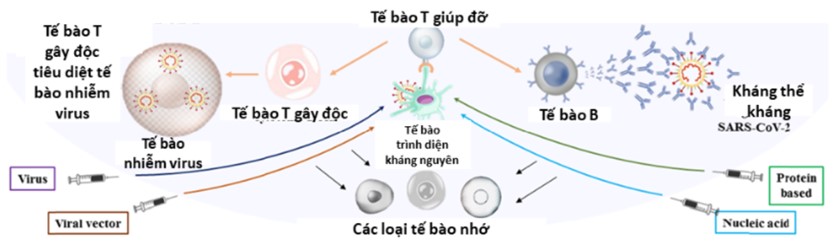
Tuy nhiên, vaccine dạng tiêm gặp hai vấn đề lớn trong việc chủng ngừa COVID-19. Đầu tiên, vaccine tiêm sẽ gây đáp ứng bên trong cơ thể, nhưng hầu hết các mầm bệnh, đặc biệt là virus SARS-CoV-2 xâm nhiễm vào cơ thể thông qua đường hô hấp. Vì vậy, việc gây đáp ứng miễn dịch trong cơ thể bằng vaccine tiêm không thể tác động trực tiếp lên các tế bào phổi – tế bào tiếp xúc trực tiếp với mầm bệnh, do đó làm giảm hiệu năng của vaccine [5]. Thứ hai, cơ chế đáp ứng miễn dịch ở các cơ quan có cấu trúc màng nhầy diễn ra một cách hoàn toàn khác biệt, đặc biệt là quá trình trình diện kháng nguyên [6]. Do đó, vaccine dạng hít được phát triển với mục tiêu giải quyết hai vấn đề nêu trên.
Cách gây đáp ứng miễn dịch giữa vaccine dạng hít và vaccine tiêm có giống nhau không?
Hệ miễn dịch của người là một hệ thống phức tạp, với sự tương tác của nhiều thành phần cũng như thông qua nhiều cơ chế khác nhau. Trong cơ thể, vaccine có thể trực tiếp tương tác với các tế bào trình diện kháng nguyên nhưng ở các cơ quan có cấu trúc màng nhầy, đặc biệt là phổi, việc trình diện kháng nguyên diễn ra một cách khó khăn. Vì vậy, để giải quyết vấn đề này, cơ thể con người đã phát triển cơ chế trình diện kháng nguyên riêng biệt ở các cơ quan như trên thông qua tế bào tua và tế bào M [7],[8]. Tế bào tua có khả năng bắt các giữ các cấu trúc kháng nguyên và hỗ trợ trình diện [9]. Đặc biệt, tế bào M hiện diện trên bề mặt phổi có khả năng thực bào các kháng nguyên, tuy nhiên do thiếu các enzyme phân cắt nên kháng nguyên được vận chuyển một cách toàn vẹn đến các tế bào miễn dịch đang chờ sẵn ở dưới lớp biểu mô phổi [10]. Do đó, vaccine dạng hít có vai trò là cung cấp kháng nguyên cho tế bào M trên hiện diện trên bề mặt phổi và qua đó, trực tiếp gây đáp ứng trên phổi .
Đã có loại vaccine dạng hít nào được đưa vào thử nghiệm hoặc sử dụng hay chưa?
Hiện nay, chưa có vaccine dạng hít nào được chứng nhận để sử dụng lâm sàng nhưng nhiều vaccine dạng hít đang được thử nghiệm. Đơn cử là CanSino dạng hít hiện đang được thử nghiệm lâm sàng pha I và cho thấy tiềm năng ứng dụng cũng như hiệu quả cao [11].
CanSino là một loại vaccine adenovirus. Hay nói đơn giản hơn, vaccine này sử dụng một loại virus khác không gây bệnh ở người để mang và biểu hiện cấu trúc kháng nguyên tương tự trên SARS-CoV-2. Một số vaccine tương đồng được sử dụng rộng rãi là AstraZeneca, Spunik V và Johnson n’ Johnson [12]. Đối với dạng tiêm, ở thử nghiệm lâm sàng pha III, CanSino cho thấy hiệu quả cao với 65,37%, so với 62,1% của AstraZeneca hay chỉ 50,4% của Sinovac. Đối với dạng hít, tuy chỉ ở giai đoạn thử nghiệm lâm sàng pha I nhưng CanSino cho thấy tiềm năng ứng dụng cao [11]. Cụ thể, hai liều vaccine dạng hít giúp cơ thể tạo ra được lượng kháng thể trung hòa tương đương với một liều vaccine dạng tiêm cùng loại. Tuy nhiên, lượng phân tử virus trong một liều vaccine dạng hít chỉ bằng khoảng 1-2/5 lượng phân tử virus có trong một liều vaccine dạng tiêm. Lượng kháng thể được tạo ra từ vaccine dạng hít thấp hơn vaccine dạng tiêm nhưng hiệu giá kháng thể của hai loại vaccine này là tương đương. Điều này có thể được giải thích do sự khác biệt ở vị trí tiếp nhận và cũng chỉ ra rằng tỷ lệ kháng thể trung hòa cao hơn khi gây đáp ứng miễn dịch bằng vaccine dạng hít. Bên cạnh đó, tỷ lệ mắc các triệu chứng sau khi sử dụng vaccine như đau đầu, sốt, mệt mỏi cũng ít hơn khi so với khi dùng vaccine tiêm. Cuối cùng, một trong những lợi ích luôn cần đề cập khi sử dụng vaccine dạng hít chính là giá thành và tính tiện dụng.
Tiềm năng phát triển của vaccine dạng hít là như thế nào?
Tuy chỉ mới dừng lại ở việc thử nghiệm với vaccine vector của virus nhưng nhiều dạng khác cho thấy tiềm năng phát triển to lớn. Đối với vaccine mRNA phòng ngừa SARS-CoV-2, mặc dù cho thấy hiệu quả cao nhất ở thời điểm hiện tại nhưng chưa có loại vaccine dạng hít tương ứng nào được thử nghiệm lâm sàng [13]. Một trong những vấn đề khi phát triển vaccine mRNA ở dạng hít chính là khả năng dễ phân hủy của mRNA. Vì vậy, nhiều hệ thống vận chuyển/ bảo vệ mRNA được nghiên cứu cho thấy khả năng ứng dụng để phát triển vaccine mRNA dạng hít [13]. Bên cạnh đó, sự phát triển của kỹ thuật gen-công nghệ protein tái tổ hợp có thể cung cấp cho chúng ta nhiều công cụ hữu ích trong việc phát triển vaccine dạng hít. Đơn cử là việc phát triển các protein có khả năng nhắm trúng đích tế bào M, điều này có thể giúp vận chuyển tốt các phân tử kháng nguyên đến các tế bào trình diện kháng nguyên với hiệu suất cao, qua đó giúp đáp ứng miễn dịch hiệu quả hơn [14].
Tài liệu tham khảo
[1] CDCMMWR, “COVID-19 Vaccine Breakthrough Infections Reported to CDC — United States, January 1–April 30, 2021,” MMWR Morb. Mortal. Wkly. Rep., vol. 70, 2021, doi: 10.15585/mmwr.mm7021e3.
[2] F. L. van de Veerdonk and M. G. Netea, “Rare variants increase the risk of severe COVID-19,” eLife, vol. 10, p. e67860, doi: 10.7554/eLife.67860.
[3] M. A. French and Y. Moodley, “The role of SARS‐CoV‐2 antibodies in COVID‐19: Healing in most, harm at times,” Respirol. Carlton Vic, p. 10.1111/resp.13852, May 2020, doi: 10.1111/resp.13852.
[4] “COVID-19 Vaccine: Critical Questions with Complicated Answers.” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7771841/.
[5] “Vaccination by inhalation,” MIT News | Massachusetts Institute of Technology. https://news.mit.edu/2021/vaccination-inhalation-0319 (accessed Sep. 19, 2021).
[6] P. G. Holt, “Antigen presentation in the lung,” Am. J. Respir. Crit. Care Med., vol. 162, no. 4 Pt 2, pp. S151-156, Oct. 2000, doi: 10.1164/ajrccm.162.supplement_3.15tac2.
[7] S. Kimura et al., “Airway M Cells Arise in the Lower Airway Due to RANKL Signaling and Reside in the Bronchiolar Epithelium Associated With iBALT in Murine Models of Respiratory Disease,” Front. Immunol., vol. 10, p. 1323, 2019, doi: 10.3389/fimmu.2019.01323.
[8] “The Airway Antigen Sampling System: Respiratory M Cells as an Alternative Gateway for Inhaled Antigens | The Journal of Immunology.” https://www.jimmunol.org/content/186/7/4253.
[9] P. Campana, V. Parisi, D. Leosco, D. Bencivenga, F. Della Ragione, and A. Borriello, “Dendritic Cells and SARS-CoV-2 Infection: Still an Unclarified Connection,” Cells, vol. 9, no. 9, p. 2046, Sep. 2020, doi: 10.3390/cells9092046.
[10] S. Kimura, “Molecular insights into the mechanisms of M-cell differentiation and transcytosis in the mucosa-associated lymphoid tissues,” Anat. Sci. Int., vol. 93, no. 1, pp. 23–34, Jan. 2018, doi: 10.1007/s12565-017-0418-6.
[11] S. Wu et al., “Safety, tolerability, and immunogenicity of an aerosolised adenovirus type-5 vector-based COVID-19 vaccine (Ad5-nCoV) in adults: preliminary report of an open-label and randomised phase 1 clinical trial,” Lancet Infect. Dis., p. S1473309921003960, Jul. 2021, doi: 10.1016/S1473-3099(21)00396-0.
[12] C. D. Funk, C. Laferrière, and A. Ardakani, “Target Product Profile Analysis of COVID-19 Vaccines in Phase III Clinical Trials and Beyond: An Early 2021 Perspective,” Viruses, vol. 13, no. 3, p. 418, Mar. 2021, doi: 10.3390/v13030418.
[13] M. Y. T. Chow, Y. Qiu, and J. K. W. Lam, “Inhaled RNA Therapy: From Promise to Reality,” Trends Pharmacol. Sci., vol. 41, no. 10, pp. 715–729, Oct. 2020, doi: 10.1016/j.tips.2020.08.002.
[14] D. D. Lo, J. Ling, and A. Holly Eckelhoefer, “M cell targeting by a Claudin 4 targeting peptide can enhance mucosal IgA responses,” BMC Biotechnol., vol. 12, no. 1, p. 7, Mar. 2012, doi: 10.1186/1472-6750-12-7.










Hãy là người bình luận đầu tiên