ThS Huỳnh Kiến Quang, PGS.TS Trần Văn Hiếu
Nhóm nghiên cứu Y Sinh học GMIF, Phòng thí nghiệm Cảm biến Sinh học, Khoa Sinh học - Công nghệ Sinh học, Trường Đại học Khoa học Tự nhiên, ĐHQG-HCM
----------
Tổng quan
COVID-19 là đại dịch được Tổ chức Y tế Thế giới (World Health Organization – WHO) chính thức công bố vào tháng 3 năm 2020. Đến nay, đại dịch này đã lây lan đến hầu hết các quốc gia và vùng lãnh thổ trên thế giới, gây ra nhiều hậu quả nghiêm trọng về kinh tế và xã hội trên toàn cầu. Hiện nay vẫn chưa có phác đồ và thuốc đặc trị COVID-19, dẫn đến nguy cơ tử vong vẫn sẽ tiếp tục gia tăng. Trước tình hình đó, vắc xin phòng ngừa COVID-19 vẫn luôn được đánh giá là cứu cánh hàng đầu, giúp giảm thiểu sự xâm nhiễm và nguy cơ tử vong do căn bệnh này gây ra. Trên thế giới đã có nhiều loại vắc xin được cấp phép sử dụng khẩn cấp có điều kiện tại một số quốc gia và khu vực cụ thể. Tuy nhiên, nhu cầu về vắc xin được dự đoán vẫn tiếp tục gia tăng, đặc biệt là ở các nước đang phát triển và thu nhập thấp. Điều này đặt ra yêu cầu về những loại vắc xin hiệu quả, giá thành thấp và dễ nâng cấp quy mô sản xuất. Nhóm nghiên cứu của Maria và cộng sự tại Trung tâm Nghiên cứu Linh trưởng Quốc gia Yerkes tại Đại học Emory, Hoa Kỳ đã công bố một loại vắc xin ứng viên tiềm năng chống lại SARS-CoV-2 dựa trên receptor binding domain (RBD) của virus, biểu hiện bằng tế bào nấm men và phối trộn với tá dược 3M-052-alum, một loại tá dược cải tiến từ tá dược nhôm phèn có khả năng kích thích mạnh hệ miễn dịch. Loại vắc xin ứng viên này đáp ứng các tiêu chí được đặt ra ban đầu là hiệu quả, giá thành thấp và quy mô sản xuất dễ dàng nâng cấp.
Cơ chế xâm nhiễm của SARS-CoV-2 dựa trên protein spike (S protein) trên lớp vỏ virus tương tác với thụ thể angiotensin-converting enzyme 2 (ACE2) trên bề mặt tế bào, từ đó virus có thể thâm nhập nội bào. Do đó, protein S đang là mục tiêu hàng đầu trong việc phát triển vắc xin phòng ngừa SARS-CoV-2. Đáng chú ý, receptor binding domain (RBD) trong protein S đóng vai trò chính trong việc tương tác và xâm nhiễm của virus, thế nên kháng thể anti-RBD được hệ miễn dịch tạo ra có sự tương quan cao với khả năng trung hòa virus. Không giống như vắc xin sống nhược độc, vắc xin tiểu đơn vị có khả năng gây đáp ứng miễn dịch kém và cần sử dụng tá dược để tăng cường hiệu quả vắc xin. Nhóm nghiên cứu của Maria và cộng sự trước đây đã thử nghiệm một loại tá dược có tên là 3M-052, một chất kích hoạt Toll-like receptor-7/8 (TLR-7/8) phối trộn tạo hạt nano polymer hoặc hấp thụ vào nhôm phèn (3M-052-alum). 3M-052 là một phân tử nhỏ với chuỗi acyl béo 18-C thuộc họ imidazoquinolines, khi cho 3M-052 hấp thụ vào nhôm hydroxide với sự hỗ trợ của phospholipid, ta được 3M-052-alum. Đây là tá dược có khả năng tăng cường các tế bào plasma sống lâu (long-lived plasma cells – LLPCs) đặc hiệu với protein Env của virus HIV trong cơ thể của loài linh trưởng rhesus macaque (RM). Trong khi đó, tá dược nhôm đơn lẻ lại thất bại trong việc này. Hơn nữa, nghiên cứu về vắc xin HIV Env có tá dược 3M-052 kích thích phản ứng tạo kháng thể ở niêm mạc đường sinh dục và có hiệu quả bảo vệ khỏi virus. SARS‑CoV‑2 có con đường xâm nhập chính ở các tế bào niêm mạc đường hô hấp, vì vậy việc tạo ra kháng thể đặc hiệu chống lại SARS-CoV-2 tại đường hô hấp trên, đường hô hấp dưới và trong huyết thanh là rất quan trọng.
Với các cơ sở lý thuyết và thực nghiệm trên, Maria và cộng sự đã tiến hành tạo vắc xin SARS-CoV-2 bằng cách biểu hiện đoạn RBD (amino acid vị trí 332-549 thuộc tiểu phẩn S1 của protein S) bằng hệ thống Pichia pastoris X33, sau đó thử trên loài linh trưởng RM. Tá dược sử dụng được thực hiện trong nghiên cứu là nhôm phèn đơn lẻ (alum) và 3M-052-alum, hai tá dược này có thể áp dụng trong lâm sàng và có khả năng tạo ra đáp ứng miễn dịch dịch thể và đáp ứng miễn dịch tế bào T.
Thiết kế thí nghiệm được chia làm ba nhóm (n = 5 mỗi nhóm), nhóm 1 không thử vắc xin, nhóm 2 thử với RBD + alum và nhóm 3 thử với RBD + 3M-052-alum. Nhóm 2 và nhóm 3 được chủng ngừa ba lần vào tuần 0, 4 và 9. Mẫu máu, mẫu niêm mạc (mũi và trực tràng), dịch rửa phế quản (bronchoalveolar lavage – BAL) và tuỷ xương được thu nhận để xét nghiệm. Tất cả động vật thí nghiệm được thử thách với virus thật (chủng Washington-1 – WA-1) thông qua đường mũi (intranasal – IN) và nội khí quản (intratracheal – IT) kết hợp sau khoảng 1 tháng tính từ lần chủng ngừa thứ 3. Các động vật thí nghiệm bị loạng choạng và tử vong vào ngày thứ 7 và thứ 8 sau khi thử nghiệm. Mẫu máu, dịch mũi, dịch họng, dịch rửa phế quản phế nang được thu nhận tại các thời điểm trước, sau thử thách và lúc chết của các con vật thí nghiệm đó.
Kết quả
Khả năng tạo đáp ứng miễn dịch của ứng viên vắc xin RBD + 3M-052-alum được thử nghiệm và thu được một số kết quả quan trọng như sau:
RBD+3M-052-alum có khả năng kích thích mạnh miễn dịch dịch thể
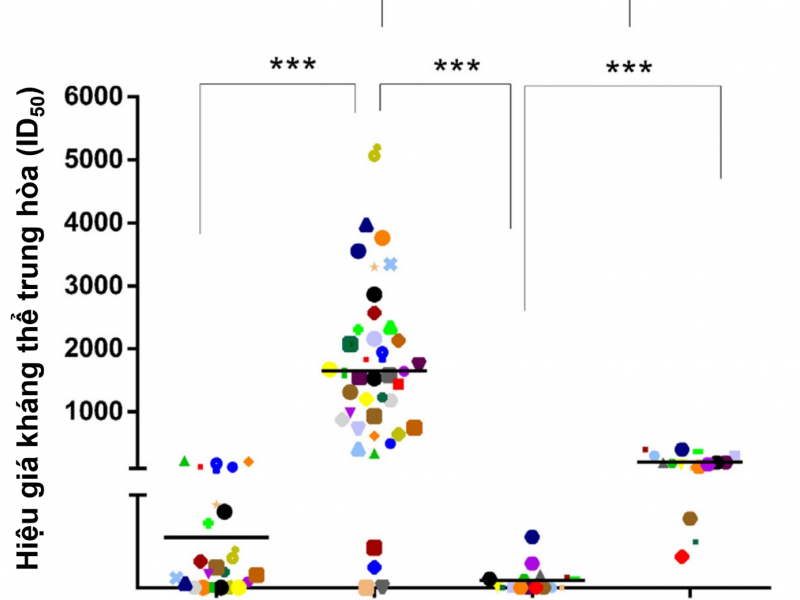
Bằng phương pháp Enzyme-linked Immunosorbent assay (ELISA), lượng kháng thể trong huyết thanh của động vật thí nghiệm đã được đánh giá, kết quả cho thấy sau 4 tuần thử nghiệm ở liều thứ nhất, kháng thể anti-RBD đã được tạo ra và lượng kháng thể tạo ra ở nhóm 3 (RBD+3M-052-alum) cao hơn nhóm 2 (RBD+alum) về mặt thống kê.
Trong thử nghiệm đánh giá khả năng trung hoà virus sống, tỷ lệ virus bị trung hoà ở liều thứ hai có vẻ còn ít và tỷ lệ này tăng lên mạnh mẽ sau khi chủng ngừa ở liều thứ ba. Biến thể virus SARS-CoV-2 D614G – biến thể đang lưu hành rộng rãi cũng được thử nghiệm khả năng trung hòa của kháng thể được tạo ra; kết quả cho thấy, cả hai nhóm thí nghiệm đều cho khả năng trung hòa biến thể virus này, đặc biệt, khả năng trung hòa virus được gia tăng rõ rệt sau khi chủng ngừa liều thứ ba.
Maria và cộng sự đã tiếp tục tiến hành thử nghiệm đánh giá sự chuyển đổi các lớp kháng thể được tạo ra trong huyết thanh của động vật thí nghiệm. Kết quả cho thấy, một lượng kháng thể IgG1 được tạo ra ở nhóm 3 cao hơn nhóm 2 về mặt thống kê, trong khi đó, ở nhóm 2 lại có lượng kháng thể IgG4 cao hơn nhóm 3. Điều này chứng tỏ đã có sự chuyển biến về hướng đáp ứng tương ứng với Th1 hay Th2 được tạo ra bởi các tá dược đi kèm (Hình 1).
Các thử nghiệm về khả năng kích thích thực bào (Antibody-dependent phagocytosis – ADP) sử dụng dòng tế bào đơn nhân người THP-1 và khả năng gây độc qua trung gian tế bào sử dụng tế bào NK của tình nguyện viên (Antibody-dependent cell cytotoxic – ADCC) cũng được thực hiện. Kết quả thu được chứng tỏ rằng, khả năng kích thích thực bào và gây độc tế bào của kháng thể trong nhóm 3 cao hơn hẳn so với nhóm 2 về mặt thống kê. Sau khi phân tích, nhóm nghiên cứu cũng cho thấy mối tương quan tương ứng của kết quả này với hiệu giá kháng thể trung hoà thu được.
Song song đó, nhóm tác giả cũng kiểm tra việc sinh kháng thể trong các vị trí miễn dịch màng nhầy tương ứng như: dịch mũi, dịch rửa phế nang, và dịch trực tràng. Các thí nghiệm trên đều cho thấy rằng việc tạo IgG trong các vị trí miễn dịch màng nhầy ở nhóm 3 luôn cao hơn nhóm 2 về mặt thống kê và việc chủng ngừa ở liều thứ ba giúp gia tăng các đáp ứng này. Các cơ sở dữ liệu trên gợi ý rằng, tá dược 3M-052-alum có những ảnh hưởng tích cực đến việc kích thích tạo kháng thể trong cơ thể của động vật thí nghiệm.

RBD+3M-052-alum có khả năng kích thích tế bào T CD8+ một cách mạnh mẽ và lâu dài, đồng thời kích thích tế bào T CD4+ theo hướng đáp ứng Th1
Để kiểm tra xem loại tế bào T nào sẽ tham gia đáp ứng, nhóm nghiên cứu đã thử tiến hành thực hiện kích thích tế bào bằng hỗn hợp peptide có chứa trình tự của protein S, sau đấy nhuộm cytokine nội bào với các kháng thể đặc hiệu cytokine tương ứng. Nhóm nghiên cứu nhận ra rằng, sau tuần 1 kể từ lần chủng ngừa đầu tiên, có đáp ứng tạo ra interferon gamma (IFN‑y) của tế bào CD8+ đặc hiệu với RBD ở một số động vật thí nghiệm. Những đáp ứng này đạt đỉnh vào tuần thứ 10 với tỷ lệ ở nhóm 3 cao hơn nhóm 2 và duy trì cho đến ngày thử thách với virus thật.
Nhóm nghiên cứu cũng nhận thấy rằng, hướng đáp ứng của tế bào T CD4+ tiết IFN‑y đặc hiệu với RBD nghiêng về Th1 chỉ quan sát thấy ở nhóm 3. Trong khi đó, ở cùng nhóm tế bào T CD4+ này ở nhóm 2 lại có xu hướng tiết cytokine interleukin-4 (IL-4) cao hơn, gợi ý rằng các đáp ứng miễn dịch này ở nhóm 2 đã nghiêng về hướng Th2. Việc tiết Tumor necrosis factor (TNF) – một chất tiết quan trọng cũng được nhóm nghiên cứu đánh giá, cho kết quả tương tự với mức độ tiết của IFN‑y ở cả hai loại tế bào T CD4+ và CD8+. Các kết quả thí nghiệm trên chứng tỏ có sự cân bằng trong đáp ứng của T CD4+ và CD8+, đồng thời mục tiêu tạo miễn dịch qua trung gian tế bào đã đạt được khi sử dụng vắc xin RBD+3M-052-alum (Hình 2).

RBD+3M-052-alum có khả năng giảm đáng kể tải lượng virus ở đường hô hấp trên và đường hô hấp dưới sau thí nghiệm thử thách với SARS-CoV-2
Các động vật thí nghiệm được thử thách với SARS-CoV-2 cách một tháng sau khi chủng ngừa liều cuối cùng qua đường mũi (intranasal – IN) và đường nội khí quản (intratracheal – IT) với liều SARS-CoV-2, WA-1 tổng số đạt 2.3 x 105 PFU. Thông tin về sự thay đổi tải lượng virus ở dịch phết mũi, dịch rửa phế quản, và dịch phết họng ở RNA tổng số và RNA subgenomic (sgRNA) được thu nhận và xử lý thống kê. Kết quả thu được cho thấy, nhóm động vật được chủng ngừa với RBD-3M-052-alum được bảo vệ trước sự xâm nhiễm của SARS-CoV-2 ở ngày thứ hai và đa số các động vật đều không phát hiện virus ở ngày thứ 4, trong khi đó ở nhóm không chủng ngừa, RNA tổng số đã được phát hiện trong dịch rửa phế quản ở ngày thứ 2. Kết quả thống kê cho thấy có sự thấp hơn rõ rệt về tải lượng virus ở nhóm 3 so với nhóm 2 và nhóm 1. Khi thực hiện kiểm tra sgRNA, chỉ 20% động vật ở nhóm 3 và 60% động vật ở nhóm 2 được phát hiện có tải lượng virus, trong khi toàn bộ 100% động vật không chủng ngừa đều phát hiện có tải lượng virus. Với kết quả này, nhóm nghiên cứu đã quan sát thấy tác động đáng kể của việc sử dụng RBD-3M-052-alum trong việc giảm tải lượng virus ở đường hô hấp dưới. Tải lượng virus ở đường hô hấp trên thể hiện trong dịch phết mũi cũng được kiểm tra, một lần nữa, kết quả của nhóm được tiêm RBD+3M-052-alum hỗ trợ giả thuyết rằng loại ứng viên vắc xin này có khả năng làm giảm áp lực về tải lượng virus ở đường hô hấp trên.
Phản ứng miễn dịch trong cơ thể có tương quan với việc bảo vệ trước sự xâm nhiễm của SARS-CoV-2
Nhằm kiểm tra các đáp ứng của hệ miễn dịch có tương quan với nhau không và có mối liên hệ nào với hiệu quả bảo vệ hay việc làm giảm mức độ virus trong đường hô hấp không, nhóm nghiên cứu đã tiến hành xử lý thống kê dữ liệu và tìm ra được một số mối tương quan đáng chú ý như sau:
- Kháng thể trung hoà SARS-CoV-2, mức độ hoạt động gây độc qua trung gian tế bào và phản ứng của kháng thể kháng RBD trong huyết thanh lẫn dịch mũi tại tuần thứ 11 tỷ lệ nghịch với sgRNA virus trong dịch phết mũi tại ngày thứ 2 sau thử thách.
- Có tỷ lệ nghịch giữa phản ứng của kháng thể kháng RBD và RNA tổng số và sgRNA virus ở ngày thử thách.
- Không có sự tương quan nào được quan sát thấy giữa phản ứng tế bào T CD4+ hoặc T CD8+ tiết IFN-y với RNA tổng số hoặc sgRNA virus trong dịch mũi.
- Phản ứng của tế bào T CD4+ tiết IFN-y tỷ lệ thuận với lượng RNA tổng số trong dịch rửa phế quản trong khi không có mối liên hệ nào được quan sát thấy giữa phản ứng tế bào T CD8+ tiết IFN-y và lượng RNA tổng số trong dịch rửa phế quản.
Các kết quả trên nhấn mạnh tầm quan trọng của việc tạo các đáp ứng lâu dài của huyết thanh chứa kháng thể kháng RBD và kháng thể trong niêm mạc trong việc bảo vệ cơ thể chống lại SARS-CoV-2.
RBD+3M-052-alum kích thích việc hình thành các tương bào trong hạch lympho
Cuộc thử nghiệm một vắc xin trước đây của nhóm nghiên cứu sử dụng cùng một loại tá dược với thử nghiệm này gợi ý rằng tế bào tiết kháng thể được vắc xin kích thích tạo ra trong máu với tỷ lệ lớn. Để kiểm chứng xem liệu vắc xin dựa trên RBD này có khả năng kích thích tương tự hay không, nhóm nghiên cứu đã tiến hành định lượng các loại tế bào này bằng kỹ thuật enzyme-linked immunospot (ELISPOT). Kết quả cho thấy, nhóm sử dụng RBD+3M-052-alum có khả năng kích thích hệ miễn dịch tạo ra nhiều tế bào tiết kháng thể IgA+ và IgG+ nhiều hơn đáng kể so với các nhóm còn lại. Tế bào tiết kháng thể này cũng được phát hiện trong tủy xương ở tuần thứ 13, tương đồng với kết quả trước, nhóm 3 có lượng tế bào tiết kháng thể này cao hơn nhóm còn lại. Đáng chú ý, một lượng lớn tế bào tiết kháng thể đặc hiệu với vắc xin RBD được quan sát thấy ở các hạch lympho ở vùng chậu và vùng kheo ở chân của các động vật thí nghiệm này. Lượng tế bào này ở nhóm 3 cao hơn đáng kể so với nhóm 2.
Tóm lại, Maria và cộng sự đã công bố một ứng viên vắc xin phòng SARS-CoV-2 tiềm năng sử dụng chính tá dược đã được nhóm nghiên cứu trước đây. Vắc xin này dựa trên vùng tương tác của virus với thụ thể người RBD được phối trộn với tá dược 3M-052-alum có khả năng kích thích mạnh hệ miễn dịch dịch thể và miễn dịch qua trung gian tế bào, đồng thời có khả năng bảo vệ cơ thể trước sự xâm nhiễm của SARS-CoV-2, làm giảm tải lượng virus trong đường hô hấp, dẫn đến việc giảm lây lan của loại virus này. Loại vắc xin này đáp ứng được yêu cầu dễ sản xuất, linh động trong việc nâng cấp quy mô do sử dụng hệ thống biểu hiện của nấm men, giúp tiết kiệm chi phí, là một sự lựa chọn tiềm năng dành cho các nước đang phát triển và có thu nhập thấp.
Lược dịch từ:
Maria Pino, Talha Abid, Susan Pereira Ribeiro, Venkata Viswanadh Edara, Katharine Floyd, Justin C. Smith, Muhammad Bilal Latif, Gabriela Pacheco-Sanchez, Debashis Dutta, Shelly Wang, Sanjeev Gumber, Shannon Kirejczyk, Joyce Cohen, Rachelle L. Stammen, Sherrie M. Jean, Jennifer S. Wood, Fawn Connor-Stroud, Jeroen Pollet, Wen-Hsiang Chen, Junfei Wei, Bin Zhan, Jungsoon Lee, Zhuyun Liu, Ulrich Strych, Neeta Shenvi, Kirk Easley, Daniela Weiskopf, Alessandro Sette, Justin Pollara, Dieter Mielke, Hongmei Gao, Nathan Eisel, Celia C. LaBranche, Xiaoying Shen, Guido Ferrari, Georgia D. Tomaras, David C. Montefiori, Rafick P. Sekaly, Thomas H. Vanderford, Mark A. Tomai, Christopher B. Fox, Mehul S. Suthar, Pamela A. Kozlowski, Peter J. Hotez, Mirko Paiardini, Maria Elena Bottazzi and Sudhir Pai Kasturi (2021). A yeast expressed RBD-based SARSS-CoV-2 vaccine formulated with 3M-052-alum adjuvant promotes protective efficacy in non-human primates. Science Immunology.









Hãy là người bình luận đầu tiên