Biên dịch: Trương Nguyễn Thúy Quỳnh, Sinh viên Y 2019 – ĐH Y dược TP. HCM;
GS. Trương Phi Hùng, Chủ nhiệm Bộ môn Dịch tễ học và Bộ môn Y học Cộng đồng – Khoa Y, ĐHQG-HCM;
BS. Dương Hải, giảng viên Bộ môn Dịch tễ học và Bộ môn Y học Cộng đồng – Khoa Y, ĐHQG-HCM
__________
THƯ NGỎ:
Từ sự lo ngại về các biến cố đông máu xảy ra sau khi tiêm vaccine ChAdOx1 nCoV-19 (Oxford-AstraZeneca) (1), một số nước châu Âu đã đề nghị lựa chọn vaccine sử dụng công nghệ mRNA ở mũi tiêm vaccine thứ hai cho những người dưới 60 hoặc 65 tuổi và đã tiêm mũi thứ nhất là vaccine ChAdOx1 nCoV-19 (2). Đến thời điểm hiện tại, các dữ liệu về mức độ an toàn và tính sinh miễn dịch của phác đồ này vẫn còn hạn chế.
Dựa trên một nghiên cứu lâm sàng đang tiến hành về tính sinh miễn dịch theo thời gian của các loại vaccine COVID-19 (mã số EudraCT, 2021-000683-30; (3) cách thức nghiên cứu (4) cùng với bản đầy đủ của bài viết có sẵn tại NEJM.org), chúng tôi tiếp cận với 88 nhân viên y tế đã được tiêm một mũi vaccine ChAdOx1 nCoV-19 vào 9-12 tuần trước. Trong đó, có 37 người lựa chọn tiêm mũi thứ hai vẫn là vaccine ChAdOx1 nCoV-19 và 51 người còn lại lựa chọn tiêm mũi thứ hai với mRNA-1273 (Moderna). Độ tuổi trung bình của hai nhóm đối tượng lần lượt là 46 (bao gồm từ 28-62 tuổi) và 40 tuổi (bao gồm từ 23-59 tuổi). Xét nghiệm máu được thực hiện tại thời điểm tiêm mũi thứ hai, vào 7-10 ngày và vào 30 ngày sau đó. Nồng độ kháng thể IgG đặc hiệu cho protein gai (S) của virus gây hội chứng hô hấp cấp nặng coronavirus 2 (SARS-CoV-2) và IgG đặc hiệu cho miền liên kết thụ thể (receptor-binding domain - RBD) được định lượng bởi kỹ thuật ELISA (xét nghiệm hấp thụ miễn dịch liên kết với Enzyme) và được thể hiện bằng diện tích dưới đường cong. Độ trung hòa huyết thanh của chủng gốc SARS-CoV-2 phân lập từ Thụy Điển (SARS-CoV-2/01/human/2020/SWE; mã số tiếp cận GenBank, MT093571.1) (5) được đo bằng phương pháp miễn dịch huỳnh quang, cho ra kết quả được thể hiện bằng sự tương hỗ với nồng độ pha loãng ức chế 50% (50% inhibitory dilution - ID50, nồng độ của hợp chất thử nghiệm tính bằng μg/mL cần thiết để ức chế 50% khả năng gây bệnh trên tế bào của virus); độ trung hòa huyết thanh của chủng gốc SARS-CoV-2 phân lập từ Thụy Điển và biến chủng B.1.351 (hay biến chủng beta) cũng được đo lường dựa trên thử nghiệm khả năng gây hủy hoại tế bào. Thông tin về khả năng gây ra phản ứng trước và sau mũi tiêm thứ hai được ghi nhận từ những người tham gia nghiên cứu. Đặc điểm nhân khẩu học của các đối tượng này và toàn bộ những chi tiết của các phương pháp nghiên cứu đều có thể tra tại phần phụ lục bổ sung của NEJM.org. (6)
Vào ngày tiêm mũi thứ hai, cả hai nhóm đều có cùng nồng độ IgG đặc hiệu cho protein S của SARS-CoV-2, IgG đặc hiệu cho RBD và kháng thể trung hòa. Sau mũi tiêm ChAdOx1 nCoV-19 thứ hai từ 7-10 ngày, nồng độ IgG đặc hiệu cho protein S và RBD tăng cao gấp 5 lần so với ngày tiêm mũi thứ hai (P<0.001); trong khi đó, với mũi tiêm thứ hai là mRNA-1273, nồng độ IgG đặc hiệu cho protein S tăng gấp 115 lần và nồng độ IgG đặc hiệu cho RBD tăng gấp 125 lần so với ngày tiêm mũi thứ hai (P<0.001) (Hình S1 ở phụ lục bổ sung). Sau 30 ngày, nồng độ IgG đặc hiệu cho protein S duy trì ở mức đạt được sau 7-10 ngày tiêm của cả hai nhóm.
Khả năng sinh kháng thể kháng protein S đặc hiệu cho SARS-CoV-2 sau mũi tiêm thứ hai với mRNA-1273 được phản ánh bởi sự gia tăng hiệu giá trung hòa huyết thanh trong ống nghiệm, cùng với sự gia tăng ID50 tại thời điểm 7-10 ngày sau khi tiêm mũi thứ hai cao gấp 20 lần so với ngay ngày tiêm (P<0.001) (Hình 1A). Ngược lại, tiêm mũi thứ hai với cùng loại ChAdOx1 nCoV-19 dẫn đến việc tăng gần như gấp đôi ID50 trong vòng 7-10 ngày (P=0.09). Một tháng sau mũi tiêm thứ hai, có sự gia tăng thêm kháng thể trung hòa ở cả hai nhóm (gấp khoảng 1,6 đến 1,7 lần so với mức sau 7-10 ngày), nhưng sự gia tăng là không đáng kể. Chúng tôi xác minh kết quả về sự trung hòa chủng gốc SARS-CoV-2 phân lập từ Thụy Điển ở một phòng thí nghiệm khác (Hình 1B). Ngoài ra, chúng tôi tìm thấy rằng mũi tiêm thứ hai với mRNA-1273 tạo được kháng thể có thể trung hòa biến chủng B.1.351 của SARS-CoV-2 (Hình 1B); tuy nhiên, mũi tiêm thứ hai với ChAdOx1 nCoV-19 lại không đem lại hiệu lực trung hòa đối với biến chủng này, một sự phát hiện phù hợp với những kết quả từ nghiên cứu trước đó. (7)
Trong nghiên cứu đoàn hệ tương đối nhỏ này, mũi tiêm thứ hai với mRNA-1273 được ghi nhận thường gây sốt, đau đầu, ớn lạnh và đau nhức cơ nhiều hơn so với mũi tiêm thứ hai của ChAdOx1 nCoV-19. Tuy nhiên, chúng tôi không tìm thấy sự khác biệt rõ ràng nào giữa hai nhóm khi so sánh về mức độ của các triệu chứng trên (Hình S2). Các biến cố bất lợi được ghi nhận cho thấy sự nhất quán với các công bố trước đó về việc sử dụng hai mũi vaccine cùng loại ChAdOx1 nCoV-19 hay kết hợp với mRNA-1273. (8)
Chúng tôi kết luận rằng vaccine mRNA-1273 có thể kích thích tế bào miễn dịch ghi nhớ lympho B đặc hiệu cho SARS-CoV-2 một cách có hiệu quả với những người đã tiêm mũi thứ nhất vaccine ChAdOx1 nCoV-19 từ 9-12 tuần trước đó và điều này có thể mang lại sự bảo vệ tốt hơn so với mũi thứ hai là ChAdOx1 nCoV-19 trước biến chủng B.1.351. Các dữ liệu này cũng cho thấy rằng các vaccine mRNA (ở đây đề cập đến mRNA-1273) có thể hiệu quả hơn cho mũi tiêm thứ ba trong các chiến dịch tiêm chủng dành cho những người đã tiêm hai mũi ChAdOx1 nCoV-19 trước đó.
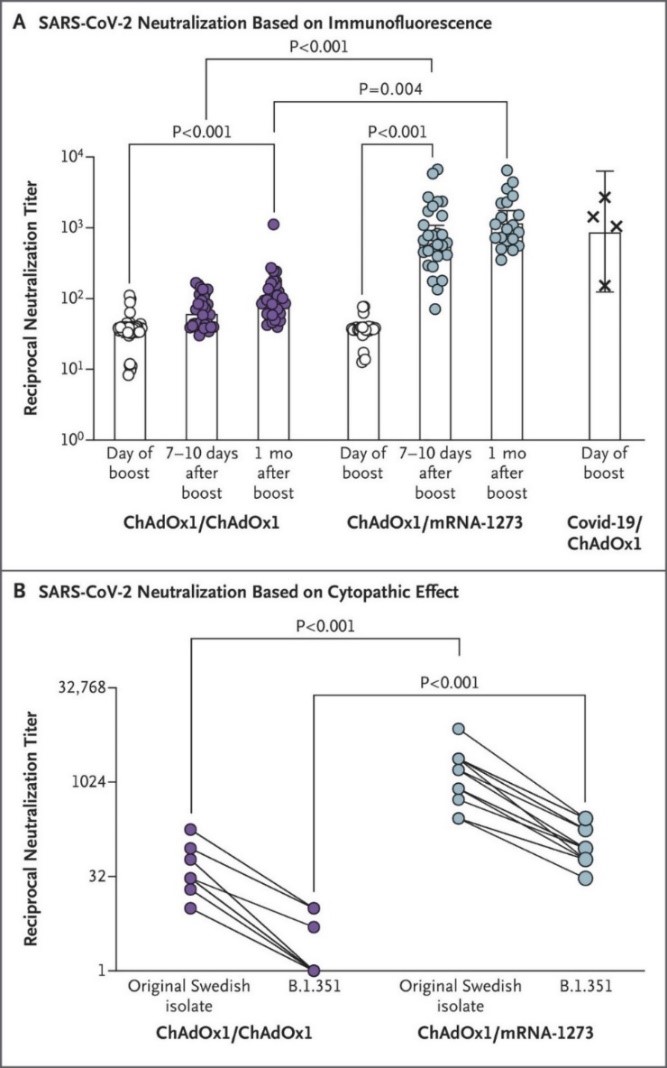
Hình 1. Sự trung hòa trong ống nghiệm trước chủng gốc SARS-CoV-2 phân lập từ Thụy Điển và biến chủng B.1.351.
Bảng A cho thấy sự trung hòa huyết thanh của chủng gốc virus gây hội chứng hô hấp cấp nặng coronavirus 2 (SARS-CoV-2) phân lập từ Thụy Điển (SARS-CoV-2/01/human/2020/SWE) vào ngày tiêm mũi thứ hai, 7-10 ngày sau và 1 tháng sau đó. Các điểm dữ liệu là sự tương hỗ của nồng độ pha loãng huyết thanh ở từng người cho thấy giảm bớt 50% sự lây nhiễm (tương hỗ với nồng độ pha loãng ức chế 50%) trong một thử nghiệm mà sự nhiễm bệnh của các tế bào Vero E6 được đo lường nhờ miễn dịch huỳnh quang đặc hiệu cho virus.
Các thanh dọc biểu thị trung bình nhân (geometric means), và các thanh ???? cho thấy khoảng tin cậy 95%. Trong nhóm đối tượng tiêm mũi hai là ChAdOx1 nCoV-19, có 35 người được phân tích mẫu xét nghiệm vào ngày tiêm, 34 người vào ngày 7-10, và 34 người vào 1 tháng sau; con số tương ứng ở nhóm được tiêm mũi hai là mRNA-1273 lần lượt là 26, 28 và 20. Như đã đề cập, đáp ứng trung hòa của kháng thể đối với SARS-CoV-2 ở 4 người mắc virus corona 2019 (COVID-19) và được tiêm một liều vaccine ChAdOx1 nCoV-19 trong 9-12 tuần trước khi lấy mẫu cũng được định lượng. Bảng B cho thấy sự trung hòa huyết thanh của chủng gốc SARS-CoV-2 phân lập từ Thụy Điển và biến chủng B.1.351 tại thời điểm 7-10 ngày, với sự trung hòa được đánh giá ở mức thấp nhất của nồng độ pha loãng huyết thanh tương hỗ, khả năng gây bệnh của SARS-CoV-2 trên tế bào Vero E6 bị giảm từ 50% trở lên (hiệu quả gây độc tế bào 50%). Mẫu xét nghiệm từ 18 đối tượng trong nhóm được tiêm mũi hai là ChAdOx1 nCoV-19 và 16 đối tượng trong nhóm được tiêm mũi hai là mRNA-1273 cũng được phân tích. Tất cả các xét nghiệm đều được thực hiện với mức độ an toàn sinh học cấp độ 3 ở Đại học Umeå (Bảng A) hoặc viện Karolinska (Bảng B).
CÁC TÁC GIẢ:
Johan Normark, M.D., Ph.D.
Linnea Vikström, B.Sc.
Yong-Dae Gwon, Ph.D.
Ida-Lisa Persson, B.Sc.
Alicia Edin, M.D., Ph.D.
Tove Björsell, M.Sc.
Andy Dernstedt, M.Sc.
Umeå University, Umeå, Sweden
Wanda Christ, M.Sc.
Karolinska Institutet, Stockholm, Sweden
Staffan Tevell, M.D., Ph.D.
Region Värmland, Karlstad, Sweden
Magnus Evander, Ph.D.
Umeå University, Umeå, Sweden
Jonas Klingström, Ph.D.
Karolinska Institutet, Stockholm, Sweden
Clas Ahlm, M.D., Ph.D.
Mattias Forsell, Ph.D.
Umeå University, Umeå, Sweden
mattias.forsell@umu.se
Supported by grants from Vetenskapsrådet (2020-06235, to Dr. Forsell, and 2020-05782, to Dr. Klingström), SciLife Laboratories (VC-2020-0015, to Dr. Forsell), Region Västerbotten and Umeå University (RV-938855, to Dr. Ahlm), and the Center for Innovative Medicine (CIMED) (20200141, to Dr. Klingström). Dr. Normark is a Wallenberg Center for Molecular Medicine Associated Researcher.
Thư ngỏ được xuất bản vào ngày 14 tháng 07 năm 2021 tại NEJM.org
Toàn bộ chi tiết của mẫu công khai nghiên cứu (9) được tác giả cung cấp tại NEJM.org
Phần dữ liệu chia sẻ (10) được tác giả cung cấp toàn bộ tại NEJM.org
__________________
(1) Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination | NEJM
(2) Overview of EU/EEA country recommendations on COVID-19 vaccination with Vaxzevria, and a scoping review of evidence to guide decision-making (europa.eu)
(3) Clinical Trials register - Search for 2021-000683-30
(4) Supplement.Trial.Ahlm et al (nejm.org)
(5)Severe acute respiratory syndrome coronavirus 2 isolate SARS-CoV-2/hum - Nucleotide - NCBI (nih.gov)
(6) Microsoft Word - Normark.supplemental appendix.docx (nejm.org)
(7) Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant | NEJM
(8) Heterologous ChAdOx1 nCoV-19 and mRNA-1273 Vaccination | NEJM
(9) nejmc2110716_disclosures.pdf
(10) nejmc2110716_data-sharing.pdf
TÀI LIỆU THAM KHẢO
[1] Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. N Engl J Med 2021;384:2092-2101.
[2] European Centre for Disease Prevention and Control. Overview of EU/EEA country recommendations on COVID-19 vaccination with Vaxzevria, and a scoping review of evidence to guide decision-making. May 18, 2021
[3] Madhi SA, Baillie V, Cutland CL, et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 vaccine against the B.1.351 variant. N Engl J Med 2021; 384:1885-1898.
[4] Baden LR, El Sahly HM, Essink B, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med 2021; 384:403-416.
[5] Folegatti PM, Ewer KJ, Aley PK, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 2020; 396:467-478.




Hãy là người bình luận đầu tiên