Ngô Ngọc Phương Thuỳ, Cộng tác viên Trung tâm nghiên cứu Di truyền và Sức khoẻ sinh sản (CGRH), Khoa Y ĐHQG-HCM
ThS.BS Trần Huy Dũng, Trung tâm nghiên cứu Di truyền và Sức khoẻ sinh sản (CGRH), Khoa Y ĐHQG-HCM
---------
Tóm tắt
Từ cuối năm 2019 đến nay, SARS-CoV-2 đã gây ra đại dịch suy hô hấp cấp ở người trên toàn thế giới với hàng trăm triệu ca nhiễm và hàng triệu ca tử vong. Cho đến nay, các chính sách miễn dịch cộng đồng đang được đẩy mạnh ở nhiều quốc gia trên thế giới, trong đó có Việt Nam, nhằm hạn chế các tác động tiêu cực của virus. Gần đây, nhiều trang thông tin giới thiệu dịch vụ xét nghiệm đánh giá kháng thể chống lại SARS-CoV-2 nhằm đánh giá tình trạng miễn dịch cá thể được chia sẻ rộng rãi trên các cổng thông tin cũng như mạng xã hội. Nhiều dữ liệu từ các nghiên cứu cho thấy các xét nghiệm đánh giá kháng thể chỉ nên được áp dụng để khảo sát tình trạng miễn dịch cộng đồng, cũng như truy vết tiền sử nhiễm bệnh ở mức độ cá thể, trong trường hợp cá thể này chưa tiêm vaccine trước đó. Các khuyến cáo của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ cũng chỉ ra rằng xét nghiệm đánh giá miễn dịch chỉ có ý nghĩa về mặt dịch tễ trên cộng đồng, không có ý nghĩa trong đánh giá tình trạng miễn dịch ở mức độ cá thể do tính phức tạp của các đáp ứng miễn dịch.
Giới thiệu
Từ các ca nhiễm được báo cáo đầu tiên tại Vũ Hán, Trung Quốc vào cuối năm 2019, cho đến nay, SARS-CoV-2 đã gây ra trận đại dịch trên nhiều quốc gia và vùng lãnh thổ. Theo thống kê của Wordometer, tính tới cuối tháng 9/2021, đã có hơn 233 triệu ca nhiễm và gần 5 triệu ca tử vong do nhiễm SARS-CoV-2 [1]. Với tiềm năng của y học hiện đại, nhiều công nghệ sản xuất vaccine được phát triển sản xuất ở nhiều quốc gia, bằng nhiều phương pháp khác nhau và các vaccine này đã được phân phối đến khắp các quốc gia trên thế giới. Để hạn chế tình trạng trở nặng các triệu chứng cho nhiễm SARS-CoV-2, các chính sách tiêm chủng đã được thực hiện trên toàn cầu. Theo thống kê, tính tới ngày 27/9/2021, toàn thế giới có hơn 6,1 tỷ liều vaccine kháng lại SARS-CoV-2 được tiêm chủng, trong đó Việt Nam đã tiêm được hơn 38 triệu liều. Tính trên toàn dân số, Việt Nam đã có 32% dân số được tiêm vaccine, trong đó 8,2% đã tiêm đủ hai mũi vaccine [2]. Gần đây, nhiều thông tin truyền thông giới thiệu về dịch vụ xét nghiệm đánh giá kháng thể nhằm xem xét khả năng miễn dịch của từng cá thể chống lại sự xâm nhiễm SARS-CoV-2. Trong khi đó, các thông tin từ Bộ Y tế cũng chưa cho thấy có chỉ định xét nghiệm kháng thể trên người nhiễm virus hoặc người tiêm vaccine [3]. Vậy các xét nghiệm kháng thể có nên được áp dụng ở mức độ cá thể hay không? Bài viết này sẽ tổng hợp các bằng chứng từ các y văn về bản chất, hiệu quả của các xét nghiệm đánh giá kháng thể hiện đang lưu hành trên thế giới cũng như khả năng ứng dụng của các xét nghiệm này ở mức độ cá thể.
Các kit xét nghiệm đánh giá kháng thể kháng SARS-CoV-2 hiện hành trên thế giới
Nguyên lý của các xét nghiệm đánh giá kháng thể kháng SARS-CoV-2
Một số báo cáo cho thấy, khác với bản chất của các xét nghiệm phát hiện sự hiện diện của RNA của SARS-CoV-2, các xét nghiệm đánh giá kháng thể có thể cho phép chúng ta thu thập các dữ liệu tốt hơn về mặt dịch tễ học, từ đó có thể truy vết các trường hợp đã từng nhiễm virus trước đó [4]. Điều này có nghĩa là, với một số trường hợp nhiễm virus không triệu chứng và lượng virus trong cơ thể quá ít, dưới ngưỡng phát hiện dẫn đến kết quả RT-PCR âm tính. Tuy nhiên, các xét nghiệm đánh giá kháng thể lại cho kết quả dương tính với kháng thể IgG hoặc IgM đặc trưng cho SARS-CoV-2. Cụ thể hơn, nghiên cứu của Long Q.X. và cộng sự (2020) thực hiện đánh giá sự hiện diện của các kháng thể IgG và IgM ở 285 bệnh nhân nhiễm SARS-CoV-2 cho thấy 100% các bệnh nhân đều dương tính với IgG đặc hiệu cho virus này. Hiệu giá kháng thể IgG và IgM đều ổn định trong vòng 6 ngày sau khi bệnh nhân xảy ra quá trình chuyển đổi huyết thanh. Kết quả nghiên cứu này cũng cho thấy xét nghiệm huyết thanh học có thể hữu ích cho việc xác định tiền sử nhiễm virus ở những bệnh nhân có dấu hiệu nghi ngờ nhiễm SARS-CoV-2 nhưng lại có kết quả RT-PCR âm tính hoặc các trường hợp nhiễm virus không triệu chứng [5].
Các xét nghiệm đánh giá kháng thể dùng để phát hiện sự hiện diện của các loại kháng thể được sản sinh từ tế bào bạch cầu lympho B sau khi xảy ra quá trình trình diện kháng nguyên của hệ thống miễn dịch. Sau khi trình diện kháng nguyên, các tế bào B chưa trưởng thành (naive B cells) được hoạt hoá và dần biệt hoá thành các tương bào tiết ra các kháng thể đặc hiệu với từng epitope của tác nhân xâm nhiễm được trình diện. Kháng thể sản sinh trong các đáp ứng đầu tiên là kháng thể dạng IgM, trong khi IgG lại được sản sinh sau đó để duy trì khả năng miễn dịch bảo vệ cơ thể khỏi tác nhân xâm nhiễm [6]. Bên cạnh đó, kháng thể IgA được tìm thấy ở các màng nhầy và hoạt động như đáp ứng miễn dịch tự nhiên. Các báo cáo cũng cho thấy kháng thể kháng lại SARS-CoV-2 sản sinh vào khoảng 6-10 ngày sau khi nhiễm virus, kháng thể IgM sẽ đạt đỉnh nồng độ vào khoảng ngày thứ 12 sau nhiễm và tồn tại khoảng 35 ngày. Kháng thể IgG đạt đỉnh nồng độ vào khoảng ngày thứ 17 sau nhiễm và có thể tồn tại khoảng 49 ngày sau đó [7, 8].
Các kit xét nghiệm đánh giá kháng thể kháng SARS-CoV-2 được thương mại hoá
Tính đến ngày 30/4/2020, đã có 10 xét nghiệm đánh giá kháng thể được chấp thuận bởi FDA với độ nhạy trung bình 84,90% và độ đặc hiệu trung bình là 98,63% (Bảng 1). Các xét nghiệm đang lưu hành hiện nay gồm 4 loại chính: test nhanh (RDT – rapid diagnostic test) sử dụng phương pháp sắc ký miễn dịch (LFIA – Lateral flow immunoassays) (Hình 1), ELISA (Enzyme-link immunosorbent assays), xét nghiệm kháng thể trung hoà và CMIA (Chemiluminescent immunoassays), riêng xét nghiệm kháng thể trung hoà chỉ được phép sử dụng trong các nghiên cứu, ba phương pháp còn lại vẫn đang được phát triển thành các bộ kit thương mại [9]. Các xét nghiệm đánh giá kháng thể hiện vẫn đang được nghiên cứu phát triển trên toàn thế giới với độ nhạy và độ đặc hiệu chưa thống nhất giữa các nghiên cứu.
Bảng 1. Thông tin các xét nghiệm đánh giá kháng thể được chấp thuận bởi FDA [10]
| Hãng sản xuất | Loại xét nghiệm | Kháng thể đích | Độ nhạy (%) | Độ đặc hiệu (%) |
| Cellex | Test nhanh, LFIA | IgM và IgG | 93,75 | 96 |
| Ortho Clinical Diagnostics | ELISA | Tổng kháng thể (IgM và IgG) | 83,33 | 100 |
| Chembio Diagnostic System | Test nhanh, LFIA | IgM và IgG | 93,55 | 93,95 |
| Mount Sinai Laboratory | ELISA | IgG | 92,50 | 100 |
| Autobio Diagnostics | Test nhanh, LFIA | IgM và IgG | 88,15 | 99,04 |
| DiaSorin | CLIA | IgG | 70,90 | 99,27 |
| Ortho Clinical Diagnostics | ELISA | IgG | 87,50 | 100 |
| Abbott Laboratories | CMIA | IgG | 89,34 | 99,63 |
| Bio-Rad Laboratories | ELISA | Tổng kháng thể (IgM, IgG, IgA) | 92,16 | 99,56 |
| Wadsworth Center, New York State Department of Health | CMIA | Tổng kháng thể (IgM, IgG, IgA) | 84,90 | 98,63 |
So sánh tính chính xác của các xét nghiệm đánh giá kháng thể thương mại hiện hành
Phân tích gộp của Cochrane thực hiện đánh giá tính chính xác của các xét nghiệm đánh giá kháng thể vì mục đích chẩn đoán tiền sử nhiễm SARS-CoV-2 ở các bệnh nhân. Các xét nghiệm trong phân tích này đều là các kit xét nghiệm thương mại hiện hành trên thế giới, gồm các kit CMIA, kit test nhanh RDT, kit ELISA, dữ liệu được tổng hợp từ 57 nghiên cứu khác nhau. Kết quả chỉ ra rằng 2/3 các nghiên cứu này chỉ dựa trên kết quả phát hiện RNA của SARS-CoV-2 bằng RT-PCR khi phân tích kết quả đánh giá kháng thể nên có thể tiềm ẩn các vấn đề liên quan đến nguy cơ âm tính giả của kết quả RT-PCR. Phân tích gộp này cũng cho thấy các đánh giá trên IgG, IgM, IgA, tổng kháng thể và các phân tích kết hợp IgM/IgG đều có độ nhạy khá thấp nếu bệnh nhân đang ở giai đoạn 7 ngày đầu sau khi nhiễm virus. Độ nhạy của các xét nghiệm tăng dần ở tuần thứ hai và thứ ba sau nhiễm. Tuy nhiên, rất ít các dữ liệu đánh giá độ chính xác của các xét nghiệm đánh giá kháng thể này trên những bệnh nhân ở giai đoạn một tháng sau nhiễm. Cũng trong báo cáo phân tích gộp này, các dữ liệu dự đoán tỷ lệ dương tính giả và âm tính giả của các xét nghiệm kháng thể có mối tương quan với tỷ lệ lưu hành SARS-CoV-2 trong quần thể thực hiện xét nghiệm. Cụ thể, nếu tỷ lệ lưu hành virus trong quần thể là 5% thì tỷ lệ dương tính giả của xét nghiệm đánh giá kháng thể là 21,0% và tỷ lệ âm tính giả là 0,4%. Trong trường hợp tỷ lệ lưu hành virus trong quần thể tăng lên đến 50,0%, tỷ lệ dương tính giả của xét nghiệm đánh giá kháng thể sẽ giảm xuống khoảng 2,0% nhưng tỷ lệ âm tính giả sẽ tăng lên đến 8,0% [11]. Hơn nữa, nghiên cứu của Vanroye F. đưa ra các bằng chứng cho thấy các kit RDT đặc trưng cho kháng thể chống lại SARS-CoV-2 có thể phản ứng chéo với các tác nhân khác như ký sinh trùng sốt rét, virus Dengue gây sốt xuất huyết, sán lá gan lớn Schistosomiasis [12].
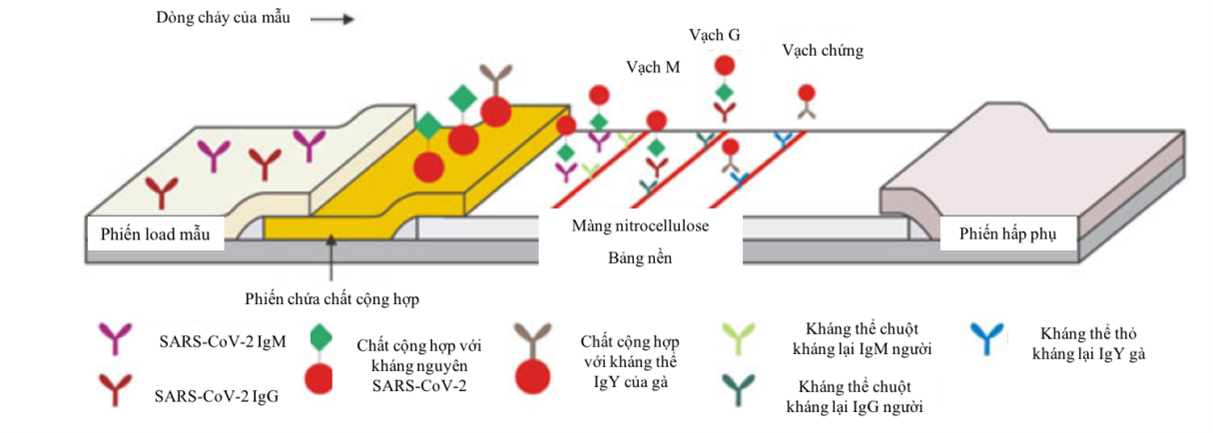
Cơ sở khoa học về đáp ứng miễn dịch chống lại SARS-CoV-2
Đáp ứng miễn dịch dịch thể
Bất kỳ tác nhân xâm nhiễm nào khi tấn công vào các tế bào của cơ thể người đều được phát hiện bởi hệ miễn dịch, từ đó kích hoạt các đáp ứng miễn dịch nhằm đào thải tác nhân gây bệnh ra khỏi cơ thể. Tuy nhiên, trong đáp ứng miễn dịch chống lại sự xâm nhiễm của SARS-CoV-2, các nghiên cứu vẫn chưa rõ thành phần cụ thể nào trong hệ miễn dịch có vai trò quan trọng nhất trong cơ chế sinh miễn dịch chống lại virus này cũng như vẫn chưa có một báo cáo nào chỉ ra rằng lượng kháng thể bao nhiêu là cần thiết để một cá thể có thể duy trì tính miễn dịch chống lại virus này theo thời gian. Đa số các bệnh nhân nhiễm SARS-CoV-2 đều cho thấy có hiện tượng chuyển đổi huyết thanh hoặc có kết quả dương tính khi thực hiện các xét nghiệm đánh giá kháng thể vào khoảng 2 tuần sau nhiễm [14]. Một báo cáo phát hiện được kháng thể chống lại SARS-CoV-2 ở bệnh nhân sớm nhất ở ngày thứ 6 sau khi khởi phát triệu chứng và lượng kháng thể tăng dần sau 3- 4 tuần [15] và có dấu hiệu giảm dần trong 2-3 tháng sau đó [16]. Mặt khác, nhiều dữ liệu nghiên cứu chỉ ra sự dao động trong nồng độ kháng thể ở các bệnh nhân phụ thuộc vào lớp kháng thể sản sinh bởi phản ứng miễn dịch dịch thể (IgM, IgG, IgA) và mức độ nặng của triệu chứng trên bệnh nhân đó. Bệnh nhân có triệu chứng nặng do nhiễm SARS-CoV-2 sẽ có nồng độ kháng thể cao hơn và các kháng thể này tồn tại trong thời gian dài hơn so với các trường hợp nhiễm virus có triệu chứng nhẹ hoặc hoàn toàn không xuất hiện triệu chứng [5]. Ở các bệnh nhân này, nồng độ kháng thể IgA và IgM giảm đi đáng kể sau 60 ngày kể từ ngày khởi phát triệu chứng, trong khi đó, nồng độ kháng thể IgG vẫn duy trì ở mức cao [8]. Kháng thể dạng IgG được chứng minh có thể duy trì trong máu bệnh nhân khoảng 90 ngày, ngay cả trong các trường hợp có triệu chứng nhẹ do nhiễm SARS-CoV-2 [17]. Như đã đề cập, nồng độ kháng thể có liên quan đến mức độ nặng của triệu chứng của bệnh nhân nhiễm virus, tuy nhiên, một báo cáo lại cho thấy động học phản ứng của các kháng thể không có sự khác biệt khi so sánh giữa các bệnh nhân có mức độ ảnh hưởng khác nhau bởi virus [18].
Kháng thể trung hoà trong đáp ứng miễn dịch dịch thể kháng SARS-CoV-2
Điều thú vị là không phải tất cả các kháng thể sản sinh ra từ các đáp ứng miễn dịch đều có khả năng chống lại virus trong những lần tái nhiễm sau đó. Chỉ có kháng thể trung hoà mới có khả năng thực sự bảo vệ cơ thể chống lại tác nhân xâm nhiễm. Một nghiên cứu cho thấy lượng kháng thể trung hoà ở những bệnh nhân nhiễm SARS-CoV-2 đã khỏi bệnh có độ dao động rất lớn [19]. Các nghiên cứu định lượng cũng chỉ ra rằng các kháng thể trung hoà chống lại SARS-CoV-2 xuất hiện sớm nhất vào ngày thứ 9 sau khi khởi phát triệu chứng và đạt đỉnh nồng độ vào khoảng ngày thứ 31-35 [20], sau đó giảm dần và có thể giảm đến mức dưới ngưỡng phát hiện sau 2-3 tháng [21]. Bên cạnh đó, vài nghiên cứu cũng ghi nhận mối tương quan giữa nồng độ kháng thể trung hoà và nồng độ tổng kháng thể IgG trong máu [22] cũng như mối tương quan với mức độ nặng của triệu chứng lâm sàng do nhiễm virus [23]. Những trường hợp có triệu chứng nặng có nồng độ kháng thể trung hoà cao hơn gấp 7 lần so với những trường hợp có triệu chứng nhẹ [23]. Như vậy, ta có thể thấy, hoạt động miễn dịch dịch thể chống lại SARS-CoV-2 ở các cá thể khác nhau có thể khác nhau từ mức độ phản ứng, đến độ đặc hiệu của phản ứng. Do đó, một số trường hợp bệnh nhân ghi nhận nồng độ kháng thể trung hoà – thành phần có chức năng chính trong việc chống lại virus, dưới ngưỡng phát hiện trong khi các kit xét nghiệm đánh giá kháng thể thương mại vẫn cho kết quả dương tính trong định lượng tổng kháng thể trong huyết tương [24].
Đáp ứng miễn dịch qua trung gian tế bào
Bên cạnh hoạt động miễn dịch dịch thể, các đáp ứng miễn dịch ở cơ thể người còn có thể hoạt động theo hướng miễn dịch qua trung gian tế bào, cụ thể hơn là các đáp ứng thông qua hoạt động của tế bào lympho T. Sau khi trình diện kháng nguyên, các tế bào lympho T chưa trưởng thành (naive T cells) sẽ biệt hoá theo hai hướng: T CD8+ và T CD4+. Tế bào T CD8+ đóng vai trò phân huỷ các tế bào bị nhiễm virus, trong khi các tế bào T CD4+ đóng vai trò kiểm soát trực tiếp hoặc gián tiếp các hoạt động của các đáp ứng miễn dịch qua trung gian tế bào, đặc biệt là việc điều hướng cho các tế bào T CD8+ đến tấn công đúng các tế bào bị nhiễm. Ngoài ra, vài báo cáo ghi nhận sự lưu hành một lượng nhỏ tế bào T nhớ trong máu sau khi nhiễm virus [25]. Nghiên cứu gần đây tìm thấy dấu vết của các tế bào T CD4+ đặc hiệu cho sự nhiễm SARS-CoV-2 hiện diện ở tất cả các bệnh nhân và 90% các trường hợp này có sự hiện diện các tế bào T CD8+. Điều này chỉ ra rằng hoạt động miễn dịch qua trung gian tế bào cũng góp phần không nhỏ trong hoạt động miễn dịch chống lại SARS-CoV-2 [26]. Tuy nhiên, các hoạt động miễn dịch thông qua trung gian tế bào không thể được đánh giá và đo lường bằng các kit thương mại đánh giá kháng thể hiện hành.
Các khuyến cáo trong việc áp dụng xét nghiệm đánh giá kháng thể
Một báo cáo của Mathur G. (2020) khuyến cáo các xét nghiệm đánh giá kháng thể có thể được sử dụng như một công cụ để khảo sát tỷ lệ nhiễm SARS-CoV-2 trong cộng đồng, đặc biệt giúp phát hiện các trường hợp nhiễm virus không triệu chứng hoặc những bệnh nhân đến khám muộn, khi mà các kết quả xác định kháng nguyên đã âm tính nhưng lại dương tính với kháng thể. Điều này chứng tỏ các trường hợp này đã nhiễm virus trước đó. Bên cạnh đó, nhiều trường hợp có kết quả dương tính với kháng thể đặc hiệu cho SARS-CoV-2 nhưng vẫn nhiễm virus sau đó, cho thấy kết quả dương tính trong các xét nghiệm đánh giá kháng thể không phản ánh được chức năng bảo vệ của các kháng thể này. Báo cáo này cũng khuyến cáo rằng nếu áp dụng rộng rãi các xét nghiệm đánh giá kháng thể ở mức độ cá thể, có thể gây ra những hiểu lầm về chức năng bảo vệ của kháng thể, dẫn đến chủ quan và các cá thể này có thể trở thành tác nhân lây lan virus cho những người xung quanh, làm tăng tỷ lệ nhiễm trên cộng đồng [10]. Ngoài ra, nếu chỉ dựa vào kết quả đánh giá kháng thể mà bỏ qua các hạn chế kỹ thuật về tỷ lệ dương tính giả và âm tính giả, có thể dẫn đến các hệ lụy khác về mặt xã hội. Những trường hợp có kết quả âm tính giả trong xét nghiệm đánh giá kháng thể không được tham gia các hoạt động xã hội trong thời kỳ mở cửa sau dịch, trong khi họ thực sự có kháng thể chống lại virus. Ngược lại, những trường hợp có kết quả dương tính giả lại có nguy cơ nới lỏng các biện pháp bảo vệ cá nhân khi tham gia các hoạt động cộng đồng, trong khi khả năng bảo vệ thực sự của kháng thể khá thấp [27].
Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ cũng đưa ra các khuyến cáo về việc sử dụng các xét nghiệm đánh giá kháng thể với nhiều điểm đáng lưu ý [28]:
- Chỉ sử dụng các test đánh giá kháng thể với mục đích chẩn đoán, xác định tiền sử nhiễm SARS-CoV-2. Không nên sử dụng để xác định tình trạng miễn dịch của bệnh nhân nhiễm virus cho đến khi các nghiên cứu lâm sàng khẳng định được các đặc tính của kháng thể đặc hiệu chống lại SARS-CoV-2.
- Không nên sử dụng xét nghiệm đánh giá kháng thể để đánh giá tình trạng miễn dịch ở những người đã tiêm vaccine ngừa SARS-CoV-2. Do một số xét nghiệm đánh giá kháng thể không thể phát hiện được các kháng thể sản sinh từ đáp ứng miễn dịch sinh ra bởi vaccine, do đặc thù phản ứng sinh miễn dịch đáp ứng với vaccine ở mỗi cá thể là khác nhau.
- Đối với những cơ sở y tế, nếu quần thể có tỷ lệ nhiễm SARS-CoV-2 >5% dân số thì các chỉ định làm xét nghiệm đánh giá kháng thể nên chọn các kit thương mại có độ đặc hiệu cao.
- Các bác sĩ được khuyến cáo chỉ định xét nghiệm đánh giá kháng thể cho những bệnh nhân đã từng hoặc đang nhiễm SARS-CoV-2.
- Các bác sĩ được khuyến cáo sử dụng các thuật toán trực giao giữa tình trạng nhiễm virus của bệnh nhân và khả năng phát hiện kháng thể, từ đó đưa ra các chỉ định xét nghiệm đánh giá kháng thể khi cần thiết.
- Vẫn chưa có bằng chứng chứng minh hiệu quả của các xét nghiệm đánh giá kháng thể, cho dù xét nghiệm đó dựa trên IgM, IgG, tổng kháng thể hoặc đánh giá kết hợp IgM/IgG. Dù vẫn có các bằng chứng có thể phát hiện được kháng thể IgA kháng lại SARS-CoV-2, CDC vẫn không khuyến cáo các bác sĩ chỉ định các xét nghiệm dựa trên IgA trong đánh giá tính sinh miễn dịch ở bệnh nhân nhiễm virus này.
Kết luận
Các xét nghiệm đánh giá kháng thể đang được thương mại hoá hiện nay chủ yếu dựa trên phản ứng định tính hoặc định lượng các kháng thể dạng IgA, IgM, IgG hoặc tổng lượng kháng thể kháng đặc hiệu với SARS-CoV-2. Các kit xét nghiệm thương mại hoá hiện tại được phát triển theo các kỹ thuật như CMIA, LFIA, ELISA giúp phát hiện kháng thể trong mẫu máu ngoại vi của bệnh nhân. Chỉ có các đáp ứng miễn dịch theo hướng miễn dịch dịch thể mới có thể sản sinh ra các kháng thể đặc hiệu kháng SARS-CoV-2. Các đáp ứng miễn dịch qua trung gian tế bào lympho T không thể sản sinh ra các kháng thể, do đó, kết quả của đáp ứng miễn dịch qua trung gian tế bào chống lại SARS-CoV-2 không thể đo lường được bởi các kit xét nghiệm đánh giá kháng thể hiện hành.
Các bằng chứng từ các nghiên cứu về tính sinh miễn dịch do SARS-CoV-2 cũng như các so sánh về độ nhạy và độ đặc hiệu của các kit xét nghiệm đánh giá kháng thể hiện lưu hành trên thế giới, cùng với các khuyến cáo của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ, các xét nghiệm đánh giá kháng thể chỉ nên được ứng dụng trong các chương trình khảo sát miễn dịch cộng đồng, không nên áp dụng ở mức độ cá thể.
Kết quả xét nghiệm đánh giá kháng thể ở mức độ cá thể không mang ý nghĩa lớn về mặt y học, không phản ánh đúng tình trạng miễn dịch của cá thể đó. Ngược lại, các kết quả này có thể mang đến các hệ lụy tiêu cực ảnh hưởng đến việc tham gia các hoạt động cộng đồng của cá thể do các hạn chế về tỷ lệ dương tính giả và âm tính giả của các kỹ thuật xét nghiệm hiện hành.
Các bác sĩ lâm sàng nên cân nhắc các khuyến cáo của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh trước khi đưa ra các chỉ định xét nghiệm đánh giá kháng thể, tránh dẫn đến lãng phí cũng như giảm thiểu các hệ lụy do hiểu sai các kết quả xét nghiệm đánh giá kháng thể gây ra.
DANH MỤC TỪ VIẾT TẮT
SARS-CoV-2 Severe Acute Respiratory Syndrome Coronavirus 2
CDC Centers for Disease Control and Prevention
RNA Ribonucleic Acid
RT-PCR Reverse Transcriptase Polymerase Chain Reaction
IgM Immunoglobulin M
IgA Immunoglobulin A
IgG Immunoglobulin G
RDT Rapid Diagnostic Test (test chẩn đoán nhanh)
LFIA Lateral Flow Immunoassays (Sắc ký miễn dịch)
ELISA Enzyme-linked Immunosorbent Assays
CMIA Chemiluminescent Immunoassays
CD4+ Cluster of Differentiation 4+
CD8+ Cluster of Differentiation 8+
TÀI LIỆU THAM KHẢO
- Worldometers. [updated 28 Sept 2021; cited 2021 28 Sept]. Available from: https://www.worldometers.info/coronavirus/
- Times TNY. Tracking Coronavirus Vaccinations Aroung the World 2021 [updated 27 Sept 2021; cited 2021 27 Sept]. Available from: https://www.nytimes.com/interactive/2021/world/covid-vaccinations-tracker.html.
- Tế BY. Xét nghiệm SARS-CoV-2: tìm kháng nguyên hay kháng thể? 2021 [updated 28 Aug 2021; cited 2021 27 Aug]. Available from: https://covid19.gov.vn/xet-nghiem-sars-cov-2-tim-khang-nguyen-hay-khang-the-1717083185.htm.
- Sullivan PS, Sailey C, Guest JL, Guarner J, Kelley C, Siegler AJ, et al. Detection of SARS-CoV-2 RNA and Antibodies in Diverse Samples: Protocol to Validate the Sufficiency of Provider-Observed, Home-Collected Blood, Saliva, and Oropharyngeal Samples. JMIR Public Health Surveill. 2020;6(2):e19054.
- Long Q, Liu BZ, Deng HJ. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med. 2020;26:845 – 8.
- Gronvall G, Connell N, Kobokovich A. Developing a National Strategy for Serology (Antibody Testing) in the United States. Baltimore, MD: The Johns Hopkins Center for Health Security2020 [cited 2021 28 Sept]. Available from: https://www.centerforhealthsecurity.org/our-work/publications/developing-a-national-strategy-for-serology-antibody-testing-in-the-US.
- Azkur AK, Akdis M, Azkur D, Sokolowska M, van de Veen W, Bruggen MC, et al. Immune response to SARS-CoV-2 and mechanisms of immunopathological changes in COVID-19. Allergy. 2020;75(7):1564-81.
- Yu HQ, Sun BQ, Fang ZF, Zhao JC, Liu XY, Li YM, et al. Distinct features of SARS-CoV-2-specific IgA response in COVID-19 patients. Eur Respir J. 2020;56(2).
- Kobokovich A, West A, Gronvall G. Serology-Based Tests for COVID-19 Baltimore, MD: The Johns Hopkins Center for Health2020 [cited 2021 28 Sept]. Available from: //www.centerforhealthsecurity.org/resources/COVID-19/ser- ology/Serology-based-tests-for-COVID-19.html. .
- Mathur G, Mathur S. Antibody testing for COVID-19: Can it be used as a screening tool in areas with low prevalence? Am J Clin Pathol. 2020;154:1 – 3.
- Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Spijker R, Taylor-Phillips S, et al. Antibody tests for identification of current and past infection with SARS-CoV-2. Cochrane Database Syst Rev. 2020;6:CD013652.
- Vanroye F, Bossche DVD, Brosius I, Tack B, Esbroeck MV, Jacobs J. COVID-19 Antibody Detecting Rapid Diagnostic Tests Show High Cross-Reactivity When Challenged with Pre-Pandemic Malaria, Schistosomiasis and Dengue Samples. Diagnostics (Basel). 2021;11(7).
- Huntley BJF, Huntley ES, Di Mascio D, Chen T, Berghella V, Chauhan SP. Rates of Maternal and Perinatal Mortality and Vertical Transmission in Pregnancies Complicated by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-Co-V-2) Infection: A Systematic Review. Obstet Gynecol. 2020;136(2):303-12.
- Prévost J. Cross-sectional evaluation of humoral responses against SARS-CoV-2 Spike. bioRxiv. 2020.
- Long Q. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 2020;26:1200 – 4.
- Cui P, Chen Z, Wang T, Dai J, Zhang J, Ding T, et al. Severe acute respiratory syndrome coronavirus 2 detection in the female lower genital tract. Am J Obstet Gynecol. 2020;223(1):131-4.
- Isho B, Abe KT, Zuo M, Jamal AJ, Rathod B, Wang JH, et al. Persistence of serum and saliva antibody responses to SARS-CoV-2 spike antigens in COVID-19 patients. Sci Immunol. 2020;5(52).
- Hou H, Wang T, Zhang B, Luo Y, Mao L, Wang F, et al. Detection of IgM and IgG antibodies in patients with coronavirus disease 2019. Clin Transl Immunology. 2020;9(5):e01136.
- Luchsinger LL, Ransegnola B, Jin D, Muecksch F, Weisblum Y, Bao W, et al. Serological Assays Estimate Highly Variable SARS-CoV-2 Neutralizing Antibody Activity in Recovered COVID19 Patients. medRxiv. 2020.
- Lee WT, Girardin RC, Dupuis AP, Kulas KE, Payne AF, Wong SJ, et al. Neutralizing Antibody Responses in COVID-19 Convalescent Sera. J Infect Dis. 2021;223(1):47-55.
- Seow J, Graham C, Merrick B, Acors S, Pickering S, Steel KJA, et al. Longitudinal observation and decline of neutralizing antibody responses in the three months following SARS-CoV-2 infection in humans. Nat Microbiol. 2020;5(12):1598-607.
- Maor Y, Cohen D, Paran N, Israely T, Ezra V, Axelrod O, et al. Compassionate use of convalescent plasma for treatment of moderate and severe pneumonia in COVID-19 patients and association with IgG antibody levels in donated plasma. EClinicalMedicine. 2020;26:100525.
- Wang P, Liu L, Nair MS, Yin MT, Luo Y, Wang Q, et al. SARS-CoV-2 neutralizing antibody responses are more robust in patients with severe disease. Emerg Microbes Infect. 2020;9(1):2091-3.
- Wu F, Liu M, Wang A, Lu L, Wang Q, Gu C, et al. Evaluating the Association of Clinical Characteristics With Neutralizing Antibody Levels in Patients Who Have Recovered From Mild COVID-19 in Shanghai, China. JAMA Intern Med. 2020;180(10):1356-62.
- Janssen EM, Droin NM, Lemmens EE, Pinkoski MJ, Bensinger SJ, Ehst BD, et al. CD4+ T-cell help controls CD8+ T-cell memory via TRAIL-mediated activation-induced cell death. Nature. 2005;434(7029):88-93.
- Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell. 2020;181(7):1489-501 e15.
- Weinstein MC, Freedberg KA, Hyle EP, Paltiel AD. Waiting for Certainty on Covid-19 Antibody Tests – At What Cost? N Engl J Med. 2020;383(6):e37.
- CDC. Interim Guidelines for COVID-19 Antibody Testing 2021 [updated 21 Sept 2021; cited 2021 28 Sept]. Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html.





Hãy là người bình luận đầu tiên