Trần Bình Minh, Khoa Công nghệ Sinh học, Trường ĐH Quốc tế, ĐHQG-HCM
PGS. TS. Nguyễn Phương Thảo, Khoa Công nghệ Sinh học, Trường ĐH Quốc tế, ĐHQG-HCM
__________
Với áp lực to lớn của đại dịch COVID-19 lên hệ thống y tế và nền kinh tế trong và ngoài nước, tiêm chủng vaccine phòng COVID-19 trở nên vô cùng cấp thiết nhằm nâng cao miễn dịch (MD) cộng đồng, từng bước đưa xã hội vào trạng thái “bình thường mới” và khôi phục kinh tế quốc gia. Trong tình hình chưa thể tự chủ sản xuất vaccine, nhu cầu tiêm chủng trong nước phụ thuộc vào viện trợ nước ngoài dẫn đến nhiều khó khăn trong mở rộng tiêm chủng. Đến hết 19/7/2021, trong nước chỉ đạt 0,3% dân số được tiêm đủ 2 mũi vaccine, thấp hơn nhiều so với các nước trên thế giới (Theo dữ liệu từ https://vnvc.vn/). Trước tình hình đó, tiêm phối trộn nhiều loại vaccine là phương án tiềm năng trong công tác điều phối tiêm phòng. Tuy nhiên, còn nhiều câu hỏi bỏ ngỏ về hiệu quả sản sinh MD, cũng như các nguy cơ tiềm ẩn khi sử dụng kết hợp vaccine.
Tiềm năng ứng dụng tiêm chủng vaccine khác loại
Đầu năm 2021, Gamaleya (Liên bang Nga) đã kết hợp vector virus rAd26 và rAd5 (Sputnik V) trong tiêm chủng đạt hiệu quả 91,6% (Logunov và cộng sự, 2021). Đơn vị tiếp tục hợp tác cùng AstraZeneca Pharmaceuticals thử nghiệm tiêm kết hợp Sputnik V-AstraZeneca (https://clinicaltrials.gov/ct2/show/NCT04686773) nhưng chưa công bố dữ liệu cụ thể. Tuy nhiên, các vaccine kể trên cùng dựa trên công nghệ vector adenovirus; trong khi đó, vẫn chưa có những nghiên cứu kết hợp nhiều công nghệ vaccine khác nhau.
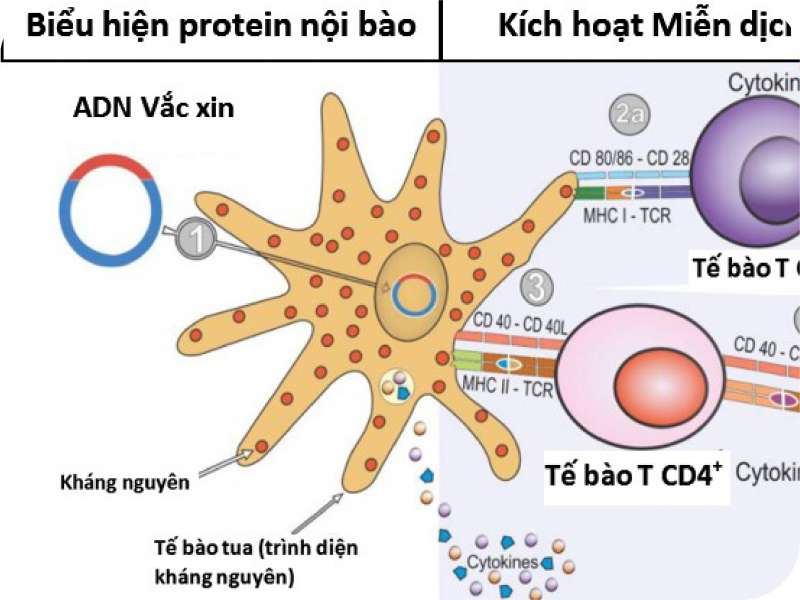
Vài tháng sau, Spencer và cộng sự đã công bố trên Nature Communications kết quả kết hợp vaccine RNA tự nhân (saRNA) và AstraZeneca trên chuột. Các mẫu huyết thanh từ nhóm thu nhận cả hai loại vaccine đã sản sinh kháng thể trung hòa SARS-Cov-2 với hàm lượng và ái lực tăng đáng kể so với sử dụng hai liều cùng loại vaccine. Kiểm nghiệm bằng virus giả định cho thấy huyết thanh từ các tổ hợp phối trộn vaccine có khả năng trung hòa tương đương sử dụng 2 liều saRNA và cao hơn 2 liều AstraZeneca. Báo cáo cũng chỉ ra khả năng hoạt hóa MD tế bào của tổ hợp hai vaccine với hàm lượng tế bào T CD8+ và interferon gamma (IFNγ) cao gấp 1,5-2,0 lần so với sử dụng một loại vaccine. Kết quả khả quan nói trên cho thấy hiệu quả kích thích MD rất tốt trên chuột, mở ra tiềm năng ứng dụng mới trong nghiên cứu phát triển vaccine phòng COVID-19 trên người.
Khả năng kích thích MD thông qua phối trộn vaccine trên người
Giữa quý II/2021, thử nghiệm lâm sàng của EICOV/COVIM (Đức) đã ghi nhận: tuy khả năng sản sinh kháng thể sau mũi tiêm đầu bằng AstraZeneca không tốt bằng Pfizer (thấp hơn 2 lần), đáp ứng MD thu được từ cả hai nhóm đối tượng trên đã đạt mức tương đương nhau sau 3 tuần kể từ khi tiến hành tiêm mũi hai bằng Pfizer. Tương tự báo cáo trên chuột, nghiên cứu này chỉ ra sự gia tăng ái lực IgG và hàm lượng IFNγ (lần lượt 1,27 và 1,34 lần) khi phối hợp hai vaccine so với tiêm chủng liều kép bằng Pfizer (Hillus và cộng sự, 2021).
Trong khi đó, Com-CoV (Anh) chỉ ra lợi thế của phối trộn AstraZeneca-Pfizer trong kích thích MD. Nhóm nghiên cứu đã báo cáo khả năng sản sinh kháng thể sau 4 tuần của tổ hợp Pfizer-Pfizer và AstraZeneca-Pfizer vượt trội (gấp 9-10 lần), theo sau là tổ hợp Pfizer-AstraZeneca (gấp 5 lần) khi so sánh với hiệu quả từ 2 mũi AstraZeneca; MD tế bào cũng được ghi nhận cao nhất với tổ hợp AstraZeneca-Pfizer, cao hơn gần 4 lần so với tổ hợp ghi nhận thấp nhất là AstraZeneca-AstraZeneca và hơn 2 lần đối với các tổ hợp còn lại (Liu và cộng sự, 2021).
Tại một số quốc gia, nhiều nghiên cứu độc lập cũng ghi nhận hiệu quả phối trộn vaccine AstraZeneca và Pfizer. Borobia và cộng sự (CombiVacS, Tây Ban Nha) tiến hành tiêm nhắc lại bằng vaccine Pfizer sau 8-12 tuần từ mũi tiêm đầu tiên bằng AstraZeneca, cho thấy hàm lượng IgG và IFNγ tăng vọt sau 2 tuần (lần lượt 37,6 và 4,2 lần) so với chỉ tiêm 1 mũi AstraZeneca. Một nghiên cứu khác tại Đức cũng nhấn mạnh khả năng trung hòa virus tốt sau 2 tuần đối với những người được áp dụng kết hợp AstraZeneca-Pfizer trước ba biến chủng Alpha (B.1.1.7), Beta (B.1.351), và Delta (B.1.617) với tác dụng cao hơn 2,0-3,9 lần, kèm theo hàm lượng tế bào Th1 cũng như tế bào T CD4+ và CD8+ cao so với sử dụng hai liều Pfizer (Groß và cộng sự, 2021).
mRNA-1273 (Moderna) - một loại vaccine RNA khác - cũng được thử nghiệm trên các nhân viên y tế đã tiếp nhận một liều vaccine AstraZeneca. Kết quả cho thấy nồng độ IgG huyết thanh sau 7-10 ngày từ khi tiêm bổ sung vaccine Moderna cao gấp 23-25 lần so với tiêm AstraZeneca lần hai, khả năng trung hòa virus được cải thiện rõ rệt (gấp 4 lần) so với với các thành viên sử dụng 2 liều vaccine AstraZeneca. Khả năng bảo vệ trước biến chủng Beta của tổ hợp AstraZeneca-Moderna cũng thể hiện tiềm năng cao, trong khi 2 liều AstraZeneca cho thấy tác dụng không đáng kể. Tuy nhiên, thử nghiệm này chỉ thực hiện trên nhóm nhỏ (88 người) và cần mở rộng nghiên cứu kiểm chứng (Normark và cộng sự, 2021).
Các phản ứng sau tiêm và nguy cơ biến chứng của tiêm chủng phối trộn vaccine
Đánh giá dựa trên nguy cơ gây biến chứng, Shaw và cộng sự nhận định, ngoài cảm giác đau tại vị trí tiêm (60-80%), một số biểu hiện cục bộ xuất hiện không đáng kể xuyên suốt tất cả tổ hợp tiêm. Bên cạnh đó, có sự tăng nhẹ tỷ lệ đau đầu, đau cơ, cóng người, và mệt mỏi đối với những người tiếp nhận mũi tiêm đầu bằng AstraZeneca so với vaccine Pfizer. Nhiều phản ứng toàn thân sau khi tiêm chủng liều hai bằng vaccine khác loại cũng có xu hướng gia tăng. Các trường hợp có cảm giác sốt khi kết hợp 2 loại vaccine chiếm 34-41%, gần gấp đôi so với sử dụng AstraZeneca (24%) hay Pfizer riêng lẻ (21%); tuy nhiên không có trường hợp sốt (trên 38°C) nào được ghi nhận. Hiện tượng đau nhức cơ-xương, mệt mỏi, nhức đầu cũng ghi nhận tỷ lệ gia tăng (>50%) khi phối trộn hai loại vaccine này.
Trái lại, đánh giá của Hillus và cộng sự trên 340 nhân viên y tế tại Đức cho thấy việc kết hợp hai loại vaccine kể trên không gây gia tăng các tác dụng phụ sau tiêm. Tỷ lệ đau và sưng đỏ vị trí tiêm tăng nhẹ trong tổ hợp phối trộn (84,9%) so với sử dụng 2 mũi Pfizer (74.2%), nhưng các biểu hiện này đều nhẹ và nhanh chóng hết sau vài ngày. Tuy nhiên, các phản ứng toàn thân (như đau đầu, đau cơ-khớp, nhức mỏi) hiếm gặp hơn khi kết hợp hai loại vaccine. Kết quả tương tự cũng được báo cáo tại Tây Ban Nha khi so sánh với những người chỉ tiêm một mũi AstraZeneca (Borobia và cộng sự, 2021).
Sự chênh lệch này có thể bắt nguồn từ sự khác biệt về thời gian giữa hai mũi tiêm trong các nghiên cứu. Cụ thể, các tình nguyện viên tại Com-CoV được thử nghiệm liều tiêm nhắc lại chỉ 4 tuần sau mũi tiêm đầu tiên; trong khi đó, các nghiên cứu tại Đức và Tây Ban Nha tiến hành tiêm chủng với khoảng cách xa hơn (8-12 tuần).
Định hướng sử dụng trong tương lai
Tuy chưa ghi nhận biến chứng nguy hiểm, việc lựa chọn vaccine phòng, chống COVID-19 vẫn cần được cân nhắc kỹ lưỡng dựa trên khuyến cáo của cơ quan y tế. Việc tự do lựa chọn vaccine vẫn chưa được khuyến khích khi các nghiên cứu lâm sàng chưa có dữ liệu đủ lớn để khẳng định tính an toàn của phương pháp này. Vì vậy, tiêm chủng đủ 02 liều cùng loại vaccine theo khuyến cáo của nhà sản xuất nên được ưu tiên; biện pháp kết hợp vaccine khác loại chỉ nên áp dụng trong các trường hợp khẩn cấp khi nguồn cung không cho phép. Với sự gia tăng nhanh chóng của các ca nhiễm COVID-19, công tác tiêm chủng phòng bệnh cần được thực hiện gấp rút nhằm nâng cao MD cộng đồng; đồng thời, cần đẩy mạnh công tác phát triển vaccine nội địa, hướng tới tự chủ sản xuất vaccine trong tình hình đại dịch diễn biến phức tạp.
Tư liệu tham khảo
Borobia, A. M., Carcas, A. J., Pérez Olmeda, M. T., Castaño, L., Jesús Bertrán, M., García-Pérez, J., Campins, M., Portolés, A., Gonzalez-Perez, M., García Morales, M. T., Arana, E., Aldea Novo, M., Díez-Fuertes, F., Fuentes-Camps, I., Ascaso, A., Lora, D., Imaz-Ayo, N., Baron-Mira, L. E., Agustí, A., … Group, C. S. (2021). Reactogenicity and Immunogenicity of BNT162b2 in Subjects Having Received a First Dose of ChAdOx1s: Initial Results of a Randomised, Adaptive, Phase 2 Trial (CombiVacS). Preprint with Lancet on SSRN Electronic Journal. https://doi.org/10.2139/ssrn.3854768
Groß, R., Zanoni, M., Seidel, A., Conzelmann, C., Gilg, A., Krnavek, D., Erdemci-Evin, S., Mayer, B., Hoffmann, M., Pöhlmann, S., Beil, A., Kroschel, J., Jahrsdörfer, B., Schrezenmeier, H., Kirchhoff, F., Münch, J., & Müller, J. A. (2021). Heterologous ChAdOx1 nCoV-19 and BNT162b2 prime-boost vaccination elicits potent neutralizing antibody responses and T cell reactivity. Preprint on MedRxiv. https://doi.org/10.1101/2021.05.30.21257971
Hillus, D., Schwarz, T., Tober-Lau, P., Hastor, H., Thibeault, C., Kasper, S., Helbig, E. T., Lippert, L. J., Tscheak, P., Schmidt, M. L., Riege, J., Solarek, A., Kalle, C. von, Dang-Heine, C., Kopankiewicz, P., Suttorp, N., Drosten, C., Bias, H., Seybold, J., … Sander, L. E. (2021). Safety, reactogenicity, and immunogenicity of homologous and heterologous prime-boost immunisation with ChAdOx1-nCoV19 and BNT162b2: A prospective cohort study. Preprint on MedRxiv. https://doi.org/10.1101/2021.05.19.21257334
Liu, X., Shaw, R. H., Stuart, A. S., Greenland, M., Dinesh, T., Provstgaard-Morys, S., Clutterbuck, E., Ramasamy, M. N., Aley, P. K., Farooq Mujadidi, Y., Long, F., Plested, E., Robinson, H., Singh, N., Walker, L. L., White, R., Andrews, N., Cameron, J. C., Collins, A. M., … Group, C.-C. S. (2021). Safety and immunogenicity report from the Com-COV study – A single-blind randomised non-inferiority trial comparing heterologous and homologous prime-boost schedules with an adenoviral vectored and mRNA COVID-19 vaccine. Preprint with the Lancet on SSRN Electronic Journal. https://doi.org/10.2139/ssrn.3874014
Logunov, D. Y., Dolzhikova, I. V., Shcheblyakov, D. V., Tukhvatulin, A. I., Zubkova, O. V., Dzharullaeva, A. S., Kovyrshina, A. V., Lubenets, N. L., Grousova, D. M., Erokhova, A. S., Botikov, A. G., Izhaeva, F. M., Popova, O., Ozharovskaya, T. A., Esmagambetov, I. B., Favorskaya, I. A., Zrelkin, D. I., Voronina, D. V., Shcherbinin, D. N., … Gintsburg, A. L. (2021). Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: An interim analysis of a randomised controlled phase 3 trial in Russia. The Lancet, 397(10275), 671–681. https://doi.org/10.1016/S0140-6736(21)00234-8
Mlcochova, P., Kemp, S., Dhar, M. S., Papa, G., Meng, B., Mishra, S., Whittaker, C., Mellan, T., Ferreira, I., Datir, R., Collier, D. A., Singh, S., Pandey, R., Marwal, R., Datta, M., Sengupta, S., Ponnusamy, K., Radhakrishnan, V. S., Abdullahi, A., … Ravindra K. Gupta1. (2021). SARS-CoV-2 B.1.617.2 Delta variant emergence and vaccine breakthrough. Preprint on Nature. https://doi.org/10.21203/rs.3.rs-637724/v1
Normark, J., Vikström, L., Gwon, Y.-D., Persson, I.-L., Edin, A., Björsell, T., Dernstedt, A., Christ, W., Tevell, S., Evander, M., Klingström, J., Ahlm, C., & Forsell, M. (2021). Heterologous ChAdOx1 nCoV-19 and mRNA-1273 Vaccination. The New England Journal of Medicine. https://doi.org/10.1056/NEJMc2110716
Shaw, R. H., Stuart, A., Greenland, M., Liu, X., Nguyen Van-Tam, J. S., & Snape, M. D. (2021). Heterologous prime-boost COVID-19 vaccination: Initial reactogenicity data. The Lancet, 397(10289), 2043–2046. https://doi.org/10.1016/S0140-6736(21)01115-6
Spencer, A. J., McKay, P. F., Belij-Rammerstorfer, S., Ulaszewska, M., Bissett, C. D., Hu, K., Samnuan, K., Blakney, A. K., Wright, D., Sharpe, H. R., Gilbride, C., Truby, A., Allen, E. R., Gilbert, S. C., Shattock, R. J., & Lambe, T. (2021). Heterologous vaccination regimens with self-amplifying RNA and adenoviral COVID vaccines induce robust immune responses in mice. Nature Communications, 12(1), 2893. https://doi.org/10.1038/s41467-021-23173-1




Hãy là người bình luận đầu tiên