Lê Tự Mạnh Huy, Lê Nguyễn Thiên Hân, Châu Ngọc Trọng Nghĩa,
ThS Nguyễn Thị Bảo Anh, TS Nguyễn Minh Hiền, Khoa Y ĐHQG-HCM
----------
Trong hơn một năm qua, bệnh viêm đường hô hấp cấp tính (COVID-19) do SARS-CoV-2 đã lây lan trên toàn thế giới và gây ra những ảnh hưởng nặng nề đến đời sống vật chất lẫn tinh thần của con người. Ngay từ đầu đại dịch, các công ty dược phẩm đã nhanh chóng nghiên cứu sản xuất vaccine để ngăn ngừa SARS-CoV-2, nhiều loại vaccine hiệu quả đã ra đời và được cấp phép sử dụng khẩn cấp tại nhiều quốc gia. Tuy nhiên, nhiều người vẫn còn do dự trong việc tiêm ngừa bởi lo ngại về tác dụng không mong muốn mà vaccine gây ra. Vậy, tác dụng không mong muốn của vaccine là gì và cần nhìn nhận như thế nào cho đúng đắn?
Vaccine mRNA của Pfizer và Moderna được chú ý nhiều nhất bởi hiệu quả ngăn ngừa lây nhiễm SARS-CoV-2 và giảm số ca nhập viện [1, 2]. Tuy nhiên, cùng với đó là những lo ngại về các tác dụng không mong muốn trong tiêm ngừa [3, 4]. Phần lớn các triệu chứng bao gồm sốt, nhức đầu, đau cơ và cảm giác khó chịu, là các phản ứng cục bộ và khởi phát chậm. Các tình trạng này ghi nhận ở khoảng 60% người sau khi tiêm liều vaccine thứ hai và là chủ đề “nóng” trên báo chí và giới khoa học nhưng nguyên nhân thực sự của tác dụng không mong muốn này hầu như không được chú ý. Vậy đâu mới thực sự là nguyên nhân của tình trạng này? Thực tế, hầu hết các triệu chứng là hệ quả của sự sản xuất quá mức cytokin―các chất hóa học đóng vai trò quan trọng trong việc đáp ứng miễn dịch ở các giai đoạn đầu của phản ứng miễn dịch, trong đó có Interferon-I (IFN-I).
IFN-I bao gồm hỗn hợp IFN-β, nhiều phân nhóm của IFN-α và một số IFN khác. IFN-I và IFN-III (IFN-λ) được tạo ra ngay sau khi tiếp xúc với mầm bệnh và có tác dụng kháng virus mạnh, IFN-I tác động khắp cơ thể và IFN-III tác động chủ yếu trong hệ hô hấp. Những hiệu ứng này ngăn chặn sự nhân lên của virus và ngăn sự phát tán virus sang những cơ quan khác của cơ thể. IFN-I được sản xuất chủ yếu bởi đại thực bào và tế bào tua thông qua tương tác với các tác nhân gây bệnh liên quan đến phân tử kiểu mẫu (PAMP) được biểu hiện bởi virus hoặc vi khuẩn gây bệnh liên quan. Sau đó, các PAMP tương tác với các thụ thể nhận biết kiểu mẫu (PRR) được biểu hiện bởi tế bào tua, bao gồm các thụ thể giống Toll (TLR) và các thụ thể giống RIG-1 [5]. Với vaccine mRNA, PAMP được nhận biết bởi PRR, cụ thể bao gồm TLR7, TLR8 và TLR9, RIG-I và protein MDA5.
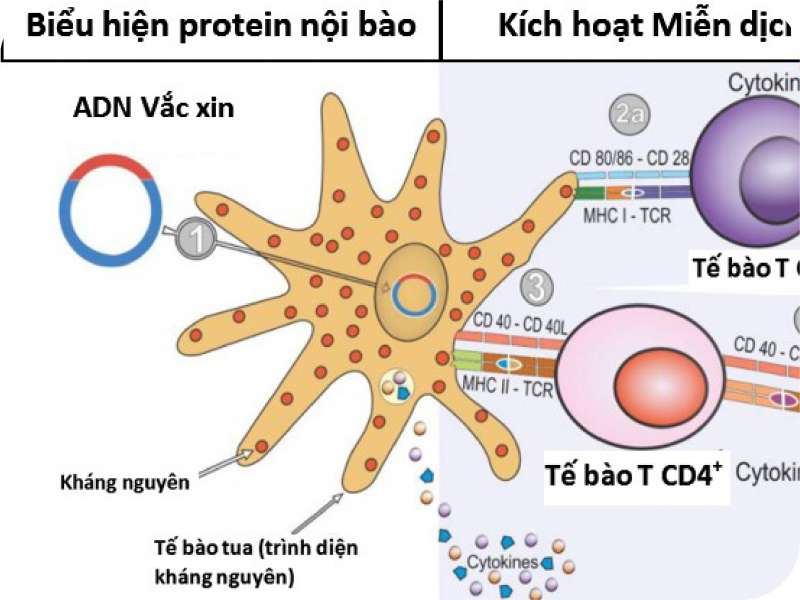
Sau khi vaccine được tiêm vào cơ thể, mRNA được dịch mã thành protein và được trình diện dưới dạng các peptid liên kết với phân tử phức hợp nhóm hòa hợp mô (MHC) trên bề mặt các tế bào T CD4+ và CD8+. Trong tế bào chất, mRNA được nhận biết bởi RIG-I, MDA5 và cả TLR trong endosom dẫn đến kích hoạt yếu tố điều hòa IFN 3/7 và yếu tố hạt nhân κB (NK-κB). Hai yếu tố này liên kết với DNA và sản xuất IFN-I cùng với các cytokin tiền viêm tương ứng [6].
Thụ thể của IFN-I có trên tất cả tế bào nhân thực. Khi IFN-I gắn với thụ thể sẽ tạo tín hiệu nội bào kích thích sản xuất các cytokin và chất trung gian hoá học để trung hòa tác nhân gây bệnh. Việc sản xuất IFN-I sớm rất quan trọng để tạo ra phản ứng miễn dịch tối ưu. IFN-I hoạt hóa tế bào tua và cho phép các tế bào trình diện kháng nguyên đến tế bào T CD4+ và CD8+ [7]. Tế bào CD4+ hoạt hóa sau đó kích thích tế bào B sản xuất kháng thể đặc hiệu. Trong khi đó, tế bào CD8+ gây độc và ly giải tế bào bị nhiễm. Đối với hai quần thể dưới tế bào T này, cơ chế này của IFN-I giúp tăng cường tính sinh miễn dịch của tế bào tua, tăng biểu hiện các phân tử kích hoạt tế bào T. Ngoài ra, IFN-I cũng tác động trực tiếp đến các tế bào T, tối ưu hóa khả năng hoạt động của các tế bào này và hình thành các tế bào ghi nhớ với tuổi thọ cao cho cả tế bào T CD4+ và CD8+.
Đối với những virus có khả năng gây bệnh cao, sự tổng hợp IFN-I có thể bị quá mức và dẫn đến hội chứng cơn bão cytokin [8, 9]. Tình trạng này có thể hiếm gặp ở những bệnh nhân mắc COVID-19 bởi khả năng ngăn cản quá trình tổng hợp IFN-I của virus dẫn đến nồng độ IFN-I giảm dưới mức trung bình, đặc biệt là nồng độ IFN-β ở trong máu [10]. Điều này cũng phủ nhận vai trò của IFN-I trong việc tổng hợp quá mức các cytokin tiền viêm như IL-6 xuất hiện ở những trường hợp bệnh nhân COVID-19 nặng. Ngoài ra, việc tìm thấy số lượng tự kháng thể lớn trong cơ thể cũng khẳng định rằng tình trạng nghiêm trọng của bệnh và nồng độ IFN-I thấp trong suốt thời kì đầu của quá trình viêm có mối liên hệ chặt chẽ với nhau [11]. Tuy nhiên, tính đến thời điểm hiện tại vẫn còn rất ít bằng chứng cho thấy IFN-I là nguyên nhân trực tiếp gây ra những triệu chứng bệnh lý trong nhiễm SARS-CoV-2.
Bằng chứng về sự sản xuất IFN-I sau khi được tiêm chủng ngừa SARS-CoV-2 vẫn còn hạn chế, tuy nhiên, rất nhiều loại mRNA vaccine (trừ Pfizer và Moderna) được biết đến như là một tác nhân gây cảm ứng mạnh với IFN-I [12]. Cần chú ý rằng, IFN-I đã được ứng dụng trong các trị liệu y học từ lâu. Hiện nay, đối với việc điều trị viêm gan B và C cũng như bệnh đa xơ cứng, việc tiêm IFN-I cũng gây ra những tác dụng không mong muốn tương tự khi tiêm vaccine COVID-19 như sốt, đau đầu và mệt mỏi. Nghiêm trọng hơn, liệu pháp sử dụng IFN-I liên tục có thể gây ra những ảnh hưởng đến nhận thức và tâm lý [13]. Nguyên nhân là do IFN-I có khả năng hoạt hóa tổng hợp nhiều loại cytokin như IL-6, IL-10 và chemokin. Tuy vậy, cơ chế dẫn đến những triệu chứng tác dụng không mong muốn kể trên vẫn gặp nhiều khó khăn để làm sáng tỏ.
Vai trò của IFN-I trong đáp ứng miễn dịch hiệu quả của cơ thể đối với SARS-CoV-2 nói riêng và những tác nhân gây bệnh khác nói chung đặt ra câu hỏi về việc vaccine sẽ kích thích gây ra miễn dịch như thế nào. Để giải thích điều này, chúng ta cần đi sâu hơn vào cơ chế tác động miễn dịch. Quá trình nhận diện kháng nguyên trên thụ thể của tế bào T xảy ra không chỉ nhờ vào MHC mà còn cần đến một “tín hiệu thứ hai”. Tín hiệu này sẽ gây ra sự tiếp xúc của giữa phân tử CD28 của tế bào T với các phân tử CD80 và CD86 trên tế bào tua. Nếu không có sự đồng kích thích này, sự đáp ứng của tế bào T sẽ dẫn đến sự dung thứ thay vì tạo ra miễn dịch. Chính vì vậy, tính chất bắt buộc đối với một vaccine là ngoài việc cung cấp một nguồn kháng nguyên đủ mạnh, vaccine còn cần phải chứa một chất phụ trợ có khả năng hoạt hóa điều hòa dương tính với quá trình đồng kích thích trên tế bào tua [15]. Nhiều thành phần của mầm bệnh phù hợp để làm chất phụ trợ, đặc biệt là mRNA và DNA. Giống như IFN-I, các chất phụ trợ kích thích tế bào tua bằng cách liên kết với PRR trên tế bào này và phát sinh tín hiệu hoạt hóa sự đồng kích thích. Một điều đáng chú ý là khả năng gây ra sự đồng kích thích này của nhiều tác nhân gây bệnh như mRNA và DNA đã được chứng minh rằng đều được thông qua bởi quá trình sản xuất IFN-I [16].
Những điều đã nói ở trên củng cố ý kiến cho rằng những triệu chứng sau tiêm của vaccine COVID-19 là hệ quả của quá trình tăng tổng hợp đột ngột IFN-I của cơ thể, đồng thời kéo theo sự đáp ứng của hệ miễn dịch. Thêm vào đó, những tác dụng không mong muốn này cũng vô cùng đa dạng tùy theo độ tuổi và giới tính của người được tiêm, khi những triệu chứng nặng hơn thường có xu hướng xảy ra ở phụ nữ nhiều hơn nam giới, ở những người trẻ nhiều hơn so với người già [17]. Điều này càng củng cố cho giả thiết các tác dụng không mong muốn sau khi tiêm mARN vaccine COVID-19 là hệ quả của sự tăng tổng hợp IFN-I của hệ miễn dịch, bởi vì nồng độ IFN-I cao hơn và khả năng đáp ứng của hệ miễn dịch cũng sẽ xảy ra mạnh hơn ở nữ giới so với nam giới và ở người trẻ so với người già [6].
Đối với trường hợp nhiễm SARS-CoV-2, nồng độ IFN-I được ghi nhận thấp hơn so với nồng độ IFN-I ở trường hợp nhiễm cúm, điều này phản ánh sự đối kháng của virus. Tuy nhiên, đối với những trường hợp bệnh cúm thì nồng độ IFN-I lại cao hơn rõ rệt, giải thích cho việc những triệu chứng “giống cúm” như sốt, đau đầu, mệt mỏi thường nhẹ hơn ở những người sau tiêm vaccine so với những bệnh nhân cúm thực sự.
Tuy nhiên, sự lo ngại về việc tiêm vaccine cũng có nguyên do của nó. Các vaccine COVID-19 đều dẫn đến việc biểu hiện chọn lọc protein nhưng lại thất bại trong việc ức chế IFN-I. Điều này giải thích tại sao sự tạo thành IFN-I ở người tiêm vaccine có thể tương đối cao hơn so với người nhiễm SARS-CoV-2. Thực tế, những người trẻ tuổi được ghi nhận có các biểu hiện triệu chứng (sốt, đau đầu, mệt mỏi) đáng kể sau khi tiêm vaccine, trong khi những bệnh nhân nhiễm SAR-CoV-2 trẻ tuổi lại không có triệu chứng rõ ràng.
Hiểu rõ cơ chế tác động của IFN-I cũng như SARS-CoV-2 lên cơ thể giúp chúng ta nhìn nhận một cách tích cực hơn về những tác dụng không mong muốn sau khi tiêm vaccine COVID-19. Những tác dụng không mong muốn này là dấu hiệu phản ánh hệ miễn dịch của chúng ta đang hoạt động hiệu quả để đáp ứng với vaccine. Nhận thức được tầm quan trọng của vaccine và lan tỏa kiến thức đến mọi người sẽ là cách nhanh nhất đẩy lùi dịch bệnh thông qua miễn dịch cộng đồng.
Bài viết này được biên soạn lại dựa theo “COVID-19 vaccine side effects: The positives about feeling bad” của hai tác giả Jonathan Sprent và Cecile King đăng trên tạp chí Science Immunology: tập 6 (số 60), ngày 22/6/2021.
Nguồn: https://immunology.sciencemag.org/content/6/60/eabj9256.
Danh mục từ viết tắt
SARS-CoV-2 Severe acute respiratory syndrome coronavirus 2
Virus gây hội chứng suy hô hấp cấp tính nặng 2
mRNA Messenger ribonucleic acid
ARN thông tin
IFN Interferon
NK-κB Nuclear factor κB
Yếu tố hạt nhân κB
IL-6 Interleukin 6
PAMP Pathogen-associated molecular pattern
Tác nhân gây bệnh liên quan đến phân tử kiểu mẫu
PRR Pattern recognition receptor
Thụ thể nhận biết kiểu mẫu
TLR Toll-like receptor
Thụ thể giống Toll
COVID-19 Coronavirus disease of 2019
Bệnh viêm đường hô hấp cấp tính do virus Corona 2019
DNA Deoxyribonucleic Acid
MHC Major histocompatibility complex
Phức hợp hòa hợp mô chủ yếu
TÀI LIỆU THAM KHẢO
- MW T, SM O, WH S, HK T, CJ L, JS S, et al. Effectiveness of Pfizer-BioNTech and Moderna Vaccines Against COVID-19 Among Hospitalized Adults Aged ≥65 Years - United States, January-March 2021. MMWR Morb Mortal Wkly Rep. 2021;70(18):674-679.
- Lopez Bernal J, Andrews N, Gower C, Robertson C, Stowe J, Tessier E, et al. Effectiveness of the Pfizer-BioNTech and Oxford-AstraZeneca vaccines on covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study. BMJ. 2021;373:n1088.
- Wadman M. Public needs to prep for vaccine side effects. Science. 2020;370(6520):1022.
- Remmel A. COVID vaccines and safety: what the research says. Nature. 2021;590:538-540.
- Nan Y, Nan G, Zhang Y-J. Interferon induction by RNA viruses and antagonism by viral pathogens. Viruses. 2014;6(12):4999-5027.
- Sprent J, King C. COVID-19 vaccine side effects: The positives about feeling bad. Sci Immunol. 2021;6(60):eabj9256.
- McNab F, Mayer-Barber K, Sher A, Wack A, O'Garra A. Type I interferons in infectious disease. Nat Rev Immunol. 2015;15(2):87-103.
- Schreiber G. The Role of Type I Interferons in the Pathogenesis and Treatment of COVID-19. Front Immunol. 2020;11:2599
- King C, Sprent J. Dual Nature of Type I Interferons in SARS-CoV-2-Induced Inflammation. Trends Immunol. 2021;42(4):312-322.
- Contoli M, Papi A, Tomassetti L, Rizzo P, Vieceli Dalla Sega F, Fortini F, et al. Blood Interferon-α Levels and Severity, Outcomes, and Inflammatory Profiles in Hospitalized COVID-19 Patients. Front Immunol. 2021;12:536.
- Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann H-H, Zhang Y, et al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science. 2020;370(6515):eabd4585.
- Cagigi A, Loré K. Immune Responses Induced by mRNA Vaccination in Mice, Monkeys and Humans. Vaccines (Basel). 2021;9(1):61.
- Russell A, Hepgul N, Nikkheslat N, Borsini A, Zajkowska Z, Moll N, et al. Persistent fatigue induced by interferon-alpha: a novel, inflammation-based, proxy model of chronic fatigue syndrome. Psychoneuroendocrinology. 2019;100:276-285.
- Ghaffar A, Đô NV. Dung thứ miễn dịch và bệnh tự miễn: Microbiology and Immunology Online; 2020 [updated 2020 Sep 2; cited 2021 Aug 9]. Available from: https://www.microbiologybook.org/Vietnamese%20Immuno/vietnamese-immchapter16.html.
- Reed SG, Orr MT, Fox CB. Key roles of adjuvants in modern vaccines. Nat Med. 2013;19(12):1597-1608.
- Proietti E, Bracci L, Puzelli S, Di Pucchio T, Sestili P, De Vincenzi E, et al. Type I IFN as a Natural Adjuvant for a Protective Immune Response: Lessons from the Influenza Vaccine Model. J Immunol. 2002;169(1):375.
- Bunders MJ, Altfeld M. Implications of Sex Differences in Immunity for SARS-CoV-2 Pathogenesis and Design of Therapeutic Interventions. Immunity. 2020;53(3):487-495.




Hãy là người bình luận đầu tiên