TS Võ Văn Giàu, Khoa Y, Đại học Quốc gia TP. HCM
TS.DS Nguyễn Thùy Trang, Khoa Dược, Trường Đại học Công nghệ TP. HCM
-----------
Tóm tắt
Rối loạn thoái hóa thần kinh gây ra chứng sa sút trí tuệ đã nổi lên như nguyên nhân sinh bệnh chủ yếu và gây tử vong ở người già trong bối cảnh đại dịch COVID-19 đang diễn biến phức tạp. Ngoài suy hô hấp, nhiều bệnh nhân COVID-19 nhập viện có biểu hiện thần kinh từ nhức đầu, mất khứu giác, đến lú lẫn và đột quỵ. Các nghiên cứu gần đây bước đầu đã chỉ ra sự nhiễm vi-rút SARS-CoV-2 có thể thúc đẩy bệnh lý sa sút trí tuệ diễn ra nhanh, trầm trọng hơn và những nguy cơ này càng rõ ràng hơn đối với bệnh nhân Alzheimer. Bài viết này sẽ cung cấp các đánh giá quan trọng về khả năng xâm nhập, cơ chế gây bệnh và hậu quả tiềm tàng của vi-rút SARS-CoV-2 lên hệ thần kinh trung ương.
Giới thiệu
Bệnh Coronavirus 2019 (COVID-19) do coronavirus 2 (SARS-CoV 2) gây hội chứng hô hấp cấp tính nghiêm trọng và đang là đại dịch toàn cầu. Đặc biệt, sự xuất hiện của nhiều biến chủng vi-rút SARS-CoV-2 mới với khả năng lây nhiễm cao đã và đang làm tình hình dịch bệnh ngày càng phức tạp. Đối mặt trước làn sóng đại dịch lần thứ 4, nước ta liên tục ghi nhận số ca nhiễm COVID-19 tăng kỷ lục mỗi ngày vượt 10.000 ca, gây ảnh hưởng nghiêm trọng đến đời sống kinh tế xã hội, đặc biệt là gánh nặng lên hệ thống y tế.
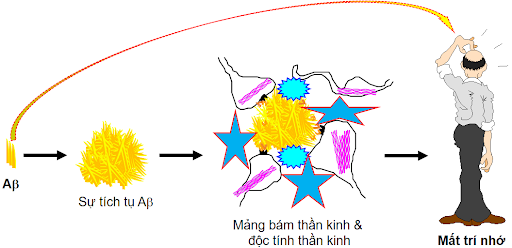
Sa sút trí tuệ là một trong những nguyên nhân chính gây bệnh mất trí nhớ và tử vong ở người cao tuổi, chiếm 50-75%. Ước tính có khoảng 50 triệu người mắc chứng sa sút trí tuệ, với gần 10 triệu trường hợp mắc mới mỗi năm trên toàn cầu. Trong số các dạng sa sút trí tuệ khác nhau, bệnh Alzheimer (AD) là dạng phổ biến nhất và chiếm 60-70% tổng các trường hợp. Sau hơn 100 năm kể từ khi được mô tả, bệnh Alzheimer vẫn là một thách thức lớn trong quản lý, chẩn đoán và điều trị. AD được xác định nguyên nhân chính do sự gấp nếp sai lệch của phân tử protein gây nên sự tích tụ và lắng đọng protein amyloid-beta (Aβ) với các gấp nếp bất thường. Đây là những peptid ngắn liên kết với nhau hợp thành các mảng bám amyloid. Sự tích tụ của các vi sợi (fibril) amyloid, được coi là dạng có độc tố làm ngăn cản cân bằng Ca2+ trong tế bào, kích hoạt sự chết tế bào theo chương trình (apoptosis) [1]. Bên cạnh đó AD cũng được xem là một chứng bệnh tauopathy do sự phosphoryl hóa quá mức của protein Tau dẫn đến protein Tau không thể liên kết với protein liên kết vi ống làm cho vi ống không ổn định. Các protein Tau ở dạng tự do này tạo ra tình trạng lộn xộn tạo thành các đám rối sợi thần kinh (NFT). Sự tập hợp các protein Aβ ngoại bào và sự hình thành protein Tau nội bào được xem là 2 dấu hiệu bệnh lý điển hình của AD. Các nguyên nhân bệnh lý khác như sự viêm, rối loạn điều hòa miễn dịch, tổn thương mạch máu, stress oxy hóa và rối loạn chức năng của ty thể cũng đóng vai trò quan trọng trong cơ chế bệnh lý AD [2] (Hình 1).
Các yếu tố nguy cơ cao đối với suy giảm nhận thức và sa sút trí tuệ bao gồm các bệnh tim mạch, tiểu đường, béo phì và tăng huyết áp [3]. Nhiều bệnh đi kèm phổ biến ở bệnh nhân sa sút trí tuệ cũng được chứng minh là yếu tố nguy cơ cao đối với bệnh nhân COVID-19 và được chứng minh trong các nghiên cứu lâm sàng gần đây [4-6]. Ở những bệnh nhân bị sa sút trí tuệ bao gồm sa sút trí tuệ mạch máu não (vascular dementia) và AD, hàng rào máu não (BBB) thường bị tổn thương mở đường cho một số vi khuẩn và vi-rút dễ dàng xâm nhập vào não hơn [7-9]. Sự thương tổn này làm cho bệnh nhân dễ bị nhiễm vi khuẩn, vi-rút và nấm hơn [10-12]. Ngoài ra, suy giảm trí nhớ liên quan đến chứng sa sút trí tuệ có thể ảnh hưởng đến bệnh nhân trong việc tuân thủ các biện pháp phòng ngừa COVID-19 như giãn cách xã hội, đeo khẩu trang và sát trùng tay thường xuyên. Nghiên cứu gần đây cũng cho thấy vi-rút SARS-CoV-2 có ảnh hưởng trực tiếp đến sự xâm nhập, gây viêm và tăng cường sự hình thành huyết khối ở não [13]. Một số cơ chế đã được đề xuất để giải thích sự tổn thương thần kinh tiềm ẩn do vi-rút SARS-CoV-2 có thể dẫn đến sự phát triển của các bệnh thoái hóa thần kinh, bao gồm bệnh Alzheimer.
Làm thế nào SARS-CoV-2 có thể xâm nhập vào não?
Mối liên hệ giữa bệnh Alzheimer và lý thuyết lây nhiễm được đưa ra từ khi có nhiều bằng chứng về sự hiện diện của các tác nhân lây nhiễm như Chlamydia pneumoniae, xoắn khuẩn Borrelia, Helicobacter pylori và vi-rút herpes simplex (HSV) trong não của bệnh nhân AD sau khi chết [14]. Sự hiện diện của HSV1 có thể đẩy nhanh quá trình phá vỡ hàng rào máu não bằng cách làm tổn thương các tế bào bên trong mạch máu [15]. Mặt khác, có sự gia tăng tải lượng các vi-rút herpesvirus 6A (HHV-6A) và herpesvirus 7 (HHV-7) ở mô não của hơn 1.000 bệnh nhân Alzheimer so với nhóm khỏe mạnh [15].
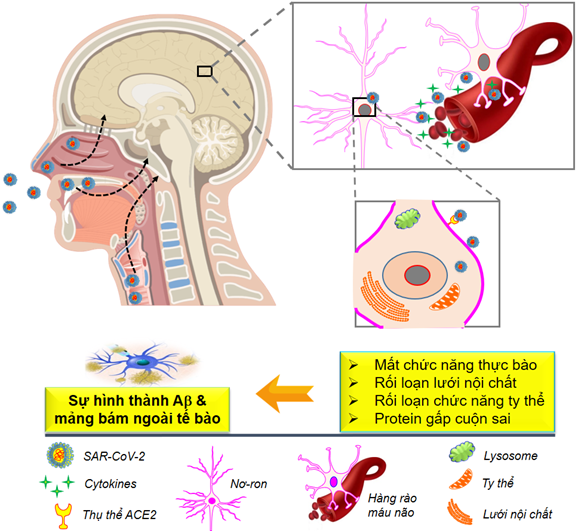
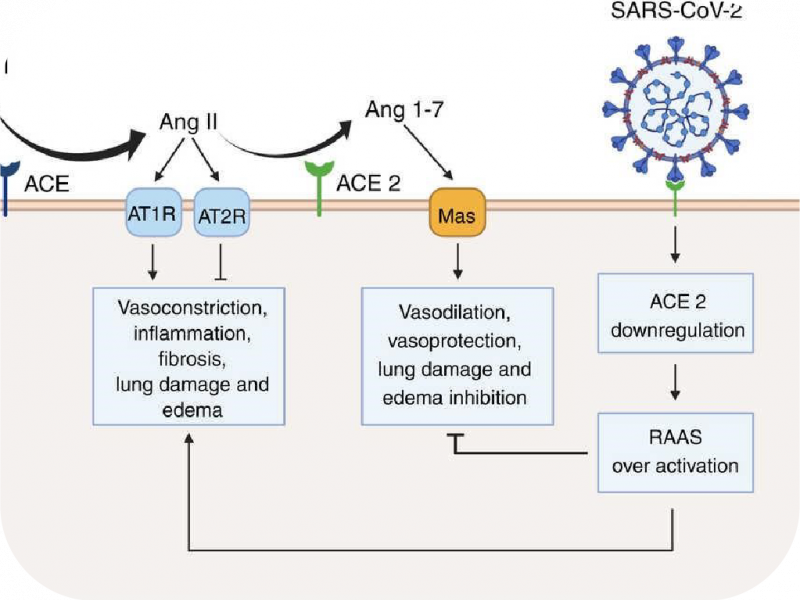
Phương thức xâm nhập chính của vi-rút SARS-CoV-2 vào cơ thể là qua đường hô hấp và do đó, vi rút xâm nhập vào các hốc mũi và hốc mũi. Cơ chế mà vi-rút SARS-CoV-2 thâm nhập vào bên trong tế bào là qua trung gian thụ thể là men chuyển angiotensin 2 (ACE2) và protease serine xuyên màng 2 (TMPRSS2). ACE2 chủ yếu hiện diện trong biểu mô đường thở, nhu mô phổi, nội mô mạch máu, thận, ruột non và não [16]. Tương tự như các bệnh nhiễm trùng đường hô hấp khác do các vi-rút như SARS-CoV-1, MERS-CoV và HCoV-OC43 [17], SARS-CoV-2 có thể lây nhiễm trực tiếp vào não, thông qua các tế bào thần kinh khứu giác và biểu mô thần kinh của niêm mạc khứu giác, đến khứu giác ở vùng dưới đồi [18] hoặc qua đường huyết quản, dễ dàng vượt qua BBB [19], gây ra phản ứng viêm trong các tế bào nội mô vi mạch, dẫn đến rối loạn chức năng BBB [19] (Hình 2). Một khi vi-rút SARS-CoV-2 xâm nhập vào hệ thần kinh trung ương, nó có thể liên kết với các tế bào thần kinh trung ương, chẳng hạn như tế bào thần kinh, tế bào hình sao, tế bào hình hạt và microglia do sự hiện diện của các thụ thể ACE2 và TMPRSS2 ở những tế bào này [20, 21]. Điều quan trọng là sự biểu hiện của thụ thể ACE2 cao hơn ở một số vùng nhất định trong não như đồi thị và đám rối mạng mạch [22].
Sự hiện diện của vi-rút SARS-CoV-2 trong các tế bào thần kinh dẫn đến việc kích hoạt các tế bào mast, microglia, tế bào hình sao, cũng như giải phóng các cytokine gây viêm ở mô. Hậu quả của viêm thần kinh có thể trở nên không kiểm soát được, đặc biệt là ở người cao tuổi, những người có phản ứng hệ thống miễn dịch kém. Viêm thần kinh, kết hợp với căng thẳng do oxy hóa mạnh, có thể gây ra sự thoái hóa thần kinh, tạo điều kiện cho sự phát triển của các bệnh thoái hóa thần kinh, chẳng hạn như AD. Bệnh nhân COVID-19 tuổi cao và thường mắc các bệnh nền chẳng hạn như tiểu đường, xơ vữa động mạch và sa sút trí tuệ cận lâm sàng, có thể tăng nguy cơ phát triển AD. Hơn nữa, rối loạn chức năng nội mô, là một đặc điểm bệnh lý của COVID-19 và tổn thương mao mạch có thể làm giảm sự thanh thải của các chất chuyển hóa ở não, bao gồm các peptide Aβ. Sự dư thừa và tích tụ của protein Aβ trong các tế bào thần kinh, đặc biệt là ở vùng hồi hải mã, đại diện cho cơ chế sinh lý bệnh chính của AD như mô tả ở Hình 1.
Tác động tiềm tàng của COVID-19 đến bệnh nhân mất trí nhớ
Các biểu hiện thần kinh do COVID-19 bao gồm đau đầu, mất khứu giác, lú lẫn, đột quỵ, xuất huyết não đến mất trí nhớ [13]. Ngày càng có nhiều bằng chứng cho thấy vi-rút SARS-CoV-2 có thể lây nhiễm các tế bào thần kinh và ảnh hưởng đến chức năng não thông qua tình trạng thiếu oxy mãn tính, rối loạn chức năng chuyển hóa, gây viêm hệ thống và rối loạn điều hòa miễn dịch [13, 23, 24]. Người ta đã đưa ra giả thuyết rằng vi-rút SARS-CoV-2 có thể gây ra tổn thương ở thần kinh trung ương bằng cách gây độc thần kinh trực tiếp hoặc gián tiếp thông qua việc kích hoạt phản ứng miễn dịch. Các cơ chế tiềm ẩn liên quan đến sự nhiễm vi-rút SARS-CoV-2 có thể làm bệnh lý sa sút trí tuệ diễn ra nhanh hơn, trầm trọng hơn và những nguy cơ này càng rõ ràng hơn đối với bệnh nhân Alzheimer, tóm tắt qua các bước: (i) sự nhiễm vi-rút SARS-CoV-2 trực tiếp đến thần kinh trung ương; (ii) đáp ứng viêm toàn thân với vi-rút SARS-CoV-2; (iii) thiếu máu cục bộ mạch máu não do rối loạn chức năng nội mô; (iv) rối loạn đông máu nghiêm trọng; (v) thở máy do hội chứng suy hô hấp cấp tính hoặc bệnh nặng; (vi) rối loạn chức năng cơ quan ngoại vi. Toàn bộ quá trình có thể gây ra nhiều hậu quả cho các nơ-ron thần kinh, một phần là do phản ứng nội bào đối với chứng viêm có thể dẫn đến sự tập hợp các protein do sự cuộn gấp sai, một đặc điểm của rối loạn thoái hóa thần kinh.
Bằng các nghiên cứu trên mô hình organoids và trên chuột chuyển gen, Song và cộng sự đã cho thấy vi-rút SARS-CoV-2 có thể lây nhiễm và gây chết tế bào thần kinh theo cách phụ thuộc vào ACE2 [25]. Mối liên hệ trong sự suy giảm nhận thức và hội chứng hô hấp cấp tính nặng do nhiễm vi-rút SARS-CoV-2 đã được báo cáo phổ biến ở những bệnh nhân bị viêm màng não, viêm não, bệnh não và bệnh mạch máu não cấp tính [26, 27]. Sự hiện diện của vi-rút SARS-CoV-2 và gây nên các cơn bão cytokine có thể đóng một vai trò quan trọng trong viêm thần kinh ở bệnh nhân COVID-19 [28, 29]. Ở những bệnh nhân đã được chẩn đoán sa sút trí tuệ, các nghiên cứu đã chỉ ra bệnh nhân Alzheimer có nguy cơ bị nhiễm COVID-19 và tỷ lệ tử vong cao hơn so với nhóm không bị sa sút trí tuệ [30-32]. Các nghiên cứu gần đây phát hiện vi-rút SARS-CoV-2 trong mô vỏ não [33], có thể gợi ý rằng nó xâm nhập vào não cũng như ở niêm mạc khứu giác [18]. Đặc biệt, các nhà nghiên cứu tại phòng khám Cleveland, bang Ohio, Mỹ, gần đây đã tiết lộ rằng rối loạn nhận thức, bao gồm cả chứng mất trí nhớ, ngày càng được báo cáo là biến chứng phổ biến ở những bệnh nhân nhiễm vi-rút SARS-CoV-2 [34]. Nhiễm trùng SARS-CoV-2 đã làm thay đổi đáng kể các dấu hiệu của bệnh Alzheimer liên quan đến viêm não và một số yếu tố xâm nhập của virus nhất định được biểu hiện nhiều trong các tế bào ở hàng rào máu não. Những phát hiện này chỉ ra rằng vi-rút có thể tác động đến một số gen hoặc con đường liên quan đến chứng viêm thần kinh và tổn thương vi mạch não, có thể dẫn đến suy giảm nhận thức giống như bệnh Alzehimer [34]. Theo một nghiên cứu gần đây ở Mỹ, COVID-19 có thể dẫn đến một loại thay đổi não thường gặp trong bệnh Alzheimer. Tuy nhiên, cơ chế chính xác của sự xâm lấn và tác động đến các tế bào thần kinh của vi-rút SARS-CoV-2 cần được nghiên cứu thêm.
Kết luận
Đại dịch COVID-19 đã dẫn đến một cuộc khủng hoảng chưa từng có đối với người cao tuổi trên toàn cầu. Có nhiều cách để vi-rút SARS-CoV-2 có thể thâm nhập đến não và các cơ chế gây tổn thương trong sự phát triển của các bệnh thoái hóa thần kinh, bao gồm cả bệnh Alzheimer. Hiện tại, vẫn còn rất ít bằng chứng để đưa ra kết luận chính xác việc nhiễm vi-rút SARS-CoV-2 có thể làm gia tăng nguy cơ phát triển bệnh Alzheimer. Tuy nhiên, mối quan hệ quan trọng giữa AD và COVID-19 dường như vẫn tồn tại.
DANH MỤC TỪ VIẾT TẮT
SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2
MERS-CoV: Middle East respiratory syndrome coronavirus
TMPRSS2: transmembrane Serine Protease 2
HCoV-OC43: Human coronavirus OC43
ACE2: Angiotensin-converting enzyme 2
COVID-19: Coronavirus disease 2019
HSV: Herpes Simplex Virus
NFT: Neurofibrillary tangles
BBB: Blood–brain barrier
AD: Alzheimer’s disease
Aβ: Amyloid beta
Tài liệu tham khảo
- Ashraf GM, Greig NH, Khan TA, Hassan I, Tabrez S, Shakil S, Sheikh IA, Zaidi SK, Akram M, Jabir NR et al: Protein misfolding and aggregation in Alzheimer's disease and type 2 diabetes mellitus. CNS Neurol Disord Drug Targets 2014, 13(7):1280-1293.
- Nguyen TT, Ta QTH, Nguyen TKO, Nguyen TTD, Vo VG: Role of Body-Fluid Biomarkers in Alzheimer's Disease Diagnosis. Diagnostics (Basel) 2020, 10(5):326.
- Giau VV, Bagyinszky E, An SS, Kim SY: Role of apolipoprotein E in neurodegenerative diseases. Neuropsychiatric disease and treatment 2015, 11:1723-1737.
- Richardson S, Hirsch JS, Narasimhan M, Crawford JM, McGinn T, Davidson KW, Consortium atNC-R: Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area. JAMA 2020, 323(20):2052-2059.
- Myers LC, Parodi SM, Escobar GJ, Liu VX: Characteristics of Hospitalized Adults With COVID-19 in an Integrated Health Care System in California. JAMA 2020, 323(21):2195-2198.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X et al: Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet (London, England) 2020, 395(10229):1054-1062.
- Sweeney MD, Sagare AP, Zlokovic BV: Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature reviews Neurology 2018, 14(3):133-150.
- Nation DA, Sweeney MD, Montagne A, Sagare AP, D'Orazio LM, Pachicano M, Sepehrband F, Nelson AR, Buennagel DP, Harrington MG et al: Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nature medicine 2019, 25(2):270-276.
- Ueno M, Chiba Y, Matsumoto K, Murakami R, Fujihara R, Kawauchi M, Miyanaka H, Nakagawa T: Blood-brain barrier damage in vascular dementia. Neuropathology : official journal of the Japanese Society of Neuropathology 2016, 36(2):115-124.
- Itzhaki RF, Lathe R, Balin BJ, Ball MJ, Bearer EL, Braak H, Bullido MJ, Carter C, Clerici M, Cosby SL et al: Microbes and Alzheimer's Disease. Journal of Alzheimer's disease : JAD 2016, 51(4):979-984.
- De Chiara G, Marcocci ME, Sgarbanti R, Civitelli L, Ripoli C, Piacentini R, Garaci E, Grassi C, Palamara AT: Infectious agents and neurodegeneration. Molecular neurobiology 2012, 46(3):614-638.
- Giau VV, Wu SY, Jamerlan A, An SSA, Kim SY, Hulme J: Gut Microbiota and Their Neuroinflammatory Implications in Alzheimer's Disease. Nutrients 2018, 10(11).
- Iadecola C, Anrather J, Kamel H: Effects of COVID-19 on the Nervous System. Cell 2020, 183(1):16-27.e11.
- Harris SA, Harris EA: Herpes Simplex Virus Type 1 and Other Pathogens are Key Causative Factors in Sporadic Alzheimer's Disease. Journal of Alzheimer's disease : JAD 2015, 48(2):319-353.
- Jeong HH, Liu Z: Are HHV-6A and HHV-7 Really More Abundant in Alzheimer's Disease? Neuron 2019, 104(6):1034-1035.
- Van Vo G, Bagyinszky E, Park YS, Hulme J, An SSA: SARS-CoV-2 (COVID-19): Beginning to Understand a New Virus. Advances in experimental medicine and biology 2021, 1321:3-19.
- Bergmann CC, Lane TE, Stohlman SA: Coronavirus infection of the central nervous system: host-virus stand-off. Nature reviews Microbiology 2006, 4(2):121-132.
- Meinhardt J, Radke J, Dittmayer C, Franz J, Thomas C, Mothes R, Laue M, Schneider J, Brünink S, Greuel S et al: Olfactory transmucosal SARS-CoV-2 invasion as a port of central nervous system entry in individuals with COVID-19. Nature neuroscience 2021, 24(2):168-175.
- Buzhdygan TP, DeOre BJ, Baldwin-Leclair A, Bullock TA, McGary HM, Khan JA, Razmpour R, Hale JF, Galie PA, Potula R et al: The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in-vitro models of the human blood-brain barrier. Neurobiology of disease 2020, 146:105131.
- Doobay MF, Talman LS, Obr TD, Tian X, Davisson RL, Lazartigues E: Differential expression of neuronal ACE2 in transgenic mice with overexpression of the brain renin-angiotensin system. American journal of physiology Regulatory, integrative and comparative physiology 2007, 292(1):R373-381.
- Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A et al: SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020, 181(2):271-280.e278.
- Pacheco-Herrero M, Soto-Rojas LO, Harrington CR, Flores-Martinez YM, Villegas-Rojas MM, León-Aguilar AM, Martínez-Gómez PA, Campa-Córdoba BB, Apátiga-Pérez R, Corniel-Taveras CN et al: Elucidating the Neuropathologic Mechanisms of SARS-CoV-2 Infection. Frontiers in Neurology 2021, 12(444).
- Solomon IH, Normandin E, Bhattacharyya S, Mukerji SS, Keller K, Ali AS, Adams G, Hornick JL, Padera RF, Sabeti P: Neuropathological Features of Covid-19. New England Journal of Medicine 2020, 383(10):989-992.
- Kanberg N, Ashton NJ, Andersson LM, Yilmaz A, Lindh M, Nilsson S, Price RW, Blennow K, Zetterberg H, Gisslén M: Neurochemical evidence of astrocytic and neuronal injury commonly found in COVID-19. Neurology 2020, 95(12):e1754-e1759.
- Song E, Zhang C, Israelow B, Lu P, Weizman O-E, Liu F, Dai Y, Szigeti-Buck K, Yasumoto Y, Wang G et al: Neuroinvasive potential of SARS-CoV-2 revealed in a human brain organoid model. bioRxiv 2020:2020.2006.2025.169946.
- Ellul MA, Benjamin L, Singh B, Lant S, Michael BD, Easton A, Kneen R, Defres S, Sejvar J, Solomon T: Neurological associations of COVID-19. The Lancet Neurology 2020, 19(9):767-783.
- Varatharaj A, Thomas N, Ellul MA, Davies NWS, Pollak TA, Tenorio EL, Sultan M, Easton A, Breen G, Zandi M et al: Neurological and neuropsychiatric complications of COVID-19 in 153 patients: a UK-wide surveillance study. The Lancet Psychiatry 2020, 7(10):875-882.
- Pezzini A, Padovani A: Lifting the mask on neurological manifestations of COVID-19. Nature Reviews Neurology 2020, 16(11):636-644.
- Matschke J, Lütgehetmann M, Hagel C, Sperhake JP, Schröder AS, Edler C, Mushumba H, Fitzek A, Allweiss L, Dandri M et al: Neuropathology of patients with COVID-19 in Germany: a post-mortem case series. The Lancet Neurology 2020, 19(11):919-929.
- Herman C, Mayer K, Sarwal A: Scoping review of prevalence of neurologic comorbidities in patients hospitalized for COVID-19. Neurology 2020, 95(2):77-84.
- Zhou J, Liu C, Sun Y, Huang W, Ye K: Cognitive disorders associated with hospitalization of COVID-19: Results from an observational cohort study. Brain, behavior, and immunity 2021, 91:383-392.
- Yu Y, Travaglio M, Popovic R, Leal NS, Martins LM: Alzheimer's and Parkinson's Diseases Predict Different COVID-19 Outcomes: A UK Biobank Study. Geriatrics (Basel, Switzerland) 2021, 6(1).
- Baig AM, Khaleeq A, Ali U, Syeda H: Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS chemical neuroscience 2020, 11(7):995-998.
- Zhou Y, Xu J, Hou Y, Leverenz JB, Kallianpur A, Mehra R, Liu Y, Yu H, Pieper AA, Jehi L et al: Network medicine links SARS-CoV-2/COVID-19 infection to brain microvascular injury and neuroinflammation in dementia-like cognitive impairment. Alzheimer's Research & Therapy 2021, 13(1):110.




Hãy là người bình luận đầu tiên