Nguyễn Phạm Tuyết Nhi, PGS.TS Nguyễn Thị Thu Hoài
nhóm nghiên cứu Vi sinh y học, Trường ĐH Quốc tế, ĐHQG-HCM
__________
Dịch bệnh truyền nhiễm viêm đường hô hấp cấp COVID-19 do vi rút SARS-COV-2 gây ra khởi nguồn từ cuối tháng 12 năm 2019 cho tới nay vẫn đang diễn biến hết sức phức tạp trên toàn thế giới. Biện pháp hữu hiệu nhất để chặn đứng COVID-19 đó chính là vắc xin. Nguyên tắc hoạt động chung của tất cả các loại vắc xin là dựa trên sự tiếp xúc giữa cơ thể với các phân tử có nguồn gốc từ mầm bệnh, nhằm kích hoạt phản ứng miễn dịch tự nhiên của cơ thể. Tuy nhiên, mỗi loại vắc xin có những phương pháp tiếp cận khác nhau, trong đó vắc xin axit nucleic (ADN và ARN) hiện được đánh giá là loại vắc xin thế hệ mới đầy triển vọng. Dưới đây, chúng tôi sẽ tổng hợp và giới thiệu những hiểu biết phổ thông về loại vắc xin này.
Đặc điểm cơ bản của vắc xin axit nucleic
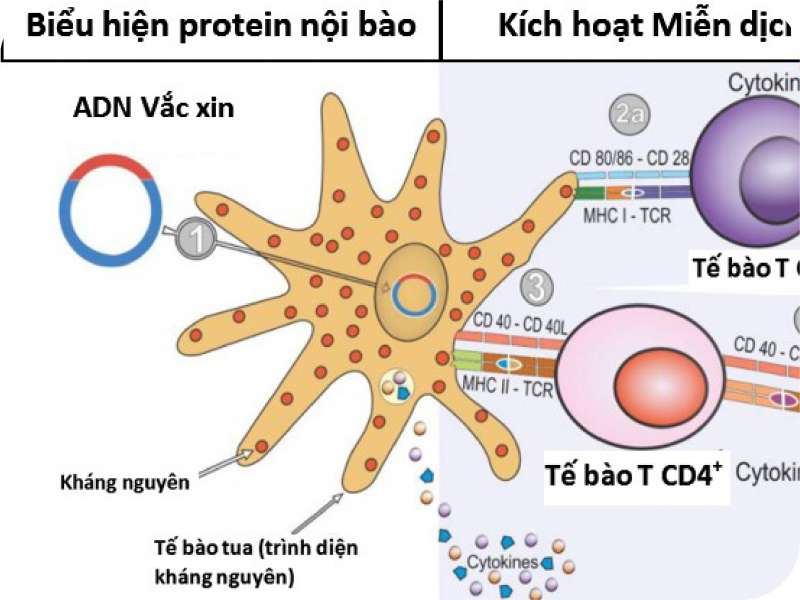
Không giống như các phương pháp tiếp cận vắc xin khác là sử dụng các bộ phận của vi khuẩn, vi rút (protein), hoặc toàn bộ mầm bệnh bị làm suy yếu, vắc xin axit nucleic chỉ sử dụng một phần vật liệu di truyền từ vi rút hoặc vi khuẩn gây bệnh để kích thích phản ứng miễn dịch của cơ thể nhằm chống lại chính mầm bệnh đó. Vật liệu di truyền sử dụng trong vắc xin có thể là ADN hoặc ARN, chứa thông tin để tạo ra một protein đặc hiệu của mầm bệnh. Sau khi vắc xin được đưa vào cơ thể, ADN (ARN) của mầm bệnh được chính bộ máy sản xuất protein tế bào của cơ thể sử dụng để tạo ra protein của mầm bệnh (kháng nguyên). Sau khi kháng nguyên hình thành, chúng được xử lý và trình diện trên bề mặt của tế bào, nơi hệ thống miễn dịch có thể phát hiện ra và kích hoạt phản ứng, dẫn tới hoạt hóa các tế bào T sát thủ (killer T cells), có chức năng tìm kiếm và tiêu diệt các tế bào chứa kháng nguyên lạ, đồng thời dưới sự trợ giúp của tế bào T hỗ trợ, các tế bào B cũng được kích hoạt sản xuất kháng thể đặc hiệu với kháng nguyên. Vì vậy, có thể nói vắc xin axit nucleic là loại có khả năng tạo ra độ bảo vệ cao với việc không chỉ tạo ra kháng thể bảo vệ như các kiểu vắc xin thế hệ cũ mà còn có khả năng kích thích tạo miễn dịch tế bào - các tế bào T bảo vệ mà vắc xin thế hệ cũ ít làm được.
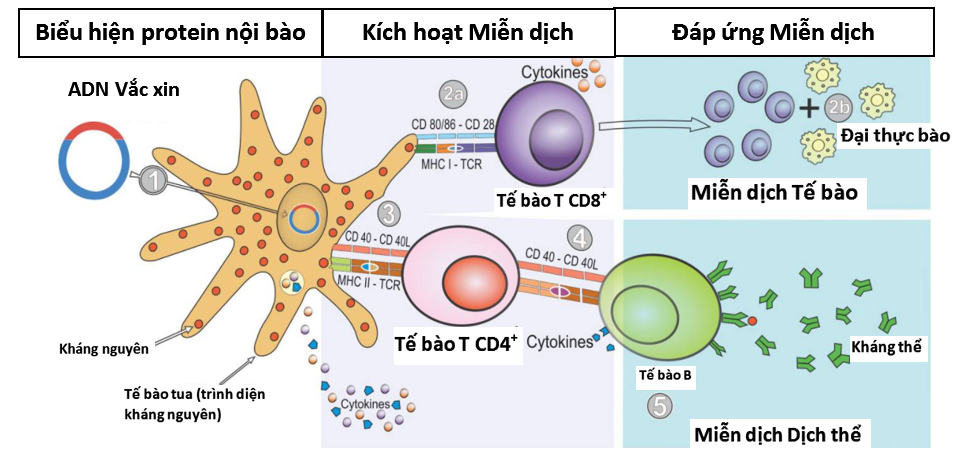
Hình 1. Sơ đồ tổng quan cơ chế hoạt động của vắc xin axit nucleic (tham khảo từ Silveira và cs. 2021)
Sơ lược lịch sử phát triển của vắc xin axit nucleic
Chiến lược nghiên cứu sản xuất vắc xin ADN tái tổ hợp đầu tiên được tiến hành vào năm 1983, do nhà vi rút học Enzo Paoletti cùng với cộng sự Dennis Panicali thực hiện tại Sở Y Tế New York, Mỹ. Họ sử dụng công nghệ gen (kỹ thuật di truyền) với mục đích tạo ra một loại vắc xin có thể ngăn ngừa các bệnh khác dựa trên sự biến đổi từ vắc xin đậu mùa thông thường. Họ bước đầu thay đổi ADN của vi rút đậu mùa bằng cách chèn một đoạn gen từ các vi rút khác (cụ thể là vi rút Herpes simplex, vi rút viêm gan B và vi rút cúm).
Năm 1993, Jeffrey Ulmer và các đồng nghiệp tại phòng thí nghiệm nghiên cứu Merck đã chứng minh rằng việc tiêm trực tiếp ADN plasmid mã hóa cho kháng nguyên cúm vào chuột đã có những phản hồi tích cực về việc bảo vệ động vật (chuột) chống lại sự lây nhiễm của vi rút cúm trong các thí nghiệm phơi nhiễm tiếp theo sau.
Năm 1996, một trong những nghiên cứu nổi bật về tính sinh miễn dịch trên động vật của vắc xin ADN HSV (Herpes simplex virus) được công bố. Virut Herpes simplex gây nhiễm trùng và vết loét da chủ yếu ở mắt, lưỡi, cổ họng, môi, bộ phận sinh dục, lây nhiễm qua sinh hoạt tiếp xúc thông thường. Các plasmid chứa các gen mã hóa cho các glycoprotein vỏ bọc vi rút này được tiêm vào chuột và chuột lang đã tạo ra đồng thời phản ứng miễn dịch dịch thể và miễn dịch tế bào, bảo vệ chuột và chuột lang khỏi mầm bệnh lây qua da và đường âm đạo.
Năm 2016, vắc xin ADN cho vi rút Zika gây bệnh ZIKV, loại bệnh truyền nhiễm do muỗi làm trung gian lây truyền đã được đưa vào thử nghiệm trên người tại viện Y tế Quốc Gia Mỹ (National Institutes of Health-NIH). Hiện nay các thử nghiệm lâm sàng đối với vắc xin ADN để ngăn ngừa HIV đang được tiến hành.
Bên cạnh đó, ARN cũng được sử dụng như một cách tiếp cận khác trong phát triển vắc xin axit nucleic. Tuy ARN kém bền, nhưng việc phát triển, thay đổi cấu trúc ARN cũng như cải tiến trong vận chuyển vật liệu di truyền, bao gồm ứng dụng các hạt nano lipid đã cho kết quả khả quan ở ARN vắc xin phòng ngừa vi rút Zika và vi rút HIV. Một nghiên cứu tiền lâm sàng năm 2020 cho thấy rằng khi chuột được tiêm vắc xin mARN-LNPs (hạt nano lipid chứa mARN) mang gen mã hóa kháng nguyên (bNAb VRC01 gen) sẽ kích thích tạo ra một lượng lớn kháng thể, có khả năng bảo vệ cao chống lại sự lây nhiễm HIV-1. Không những tạo ra kháng thể, cơ thể vật chủ sau khi được kích hoạt miễn dịch còn sản sinh ra các tế bào T-CD4+, đóng vai trò quan trọng trong việc duy trì sự ổn định của tế bào B đặc hiệu với kháng nguyên mầm bệnh.
Vắc xin axit nucleic được xem là một công nghệ tạo vắc xin với cách tiếp cận tương đối mới và đầy hứa hẹn. Tuy nhiên, do khả năng tích hợp của axit nucleic vào bộ gen vật chủ nên loại vắc xin này đòi hỏi phải được đánh giá một cách cẩn thận nhằm vừa đảm bảo an toàn vừa tăng cường tính sinh miễn dịch cao ở người. Hiện nay, ngoài một số vắc xin ADN đã được phê duyệt dành cho động vật như vắc xin cho ngựa chống lại vi rút Tây sông Nile, các vắc xin ADN, ARN tiềm năng khác đặc biệt là các vắc xin axit nucleic phòng COVID-19 cũng đang tiếp tục được nghiên cứu và phát triển.
Ứng dụng trong phát triển vắc xin phòng COVID-19
Mặc dù việc điều chế và ứng dụng vắc xin dựa trên vật liệu di truyền được quan tâm phát triển từ rất lâu nhưng chỉ dừng ở việc cấp phép trên động vật, cho tới trước khi đại dịch COVID-19 diễn ra thì vẫn chưa có loại vắc xin nào được cấp phép sử dụng cho con người. Với diễn biến phức tạp của đại dịch COVID-19, một số vắc xin axit-nucleic đã được cấp phép khẩn cấp để sử dụng cho con người tại một số nước sau khi trải qua những nghiên cứu và thử nghiệm lâm sàng nghiêm ngặt trong khi một số khác vẫn đang trong quá trình nghiên cứu đánh giá chặt chẽ.
Cả vắc xin ADN và ARN đều tương đối dễ sản xuất dù cho quy trình có đôi chút khác biệt. ADN mã hóa kháng nguyên (protein) của vi khuẩn/vi rút gây bệnh được tổng hợp và chèn vào plasmid của vi khuẩn nhận (làm nhiệm vụ chuyển ADN đích) với sự trợ giúp của các enzyme đặc hiệu. Plasmid, loại ADN mạch vòng với khả năng sao chép một cách độc lập với ADN chính của nhiễm sắc thể cung cấp một công cụ đơn giản giúp chuyển gen và biểu hiện hết sức hiệu quả. Sau đó, vô số bản sao của plasmid mang ADN mầm bệnh được tạo ra bởi sự phân chia nhanh chóng của vi khuẩn. Cuối cùng, plasmid được phân lập, tinh sạch qua nhiều bước, kết hợp các tá dược theo liều lượng và đóng gói.
Quá trình tổng hợp vắc xin ARN có phần đơn giản hơn vì có thể được thực hiện từ một khuôn mẫu trong phòng thí nghiệm mà không cần sự trợ giúp của bất kì vi khuẩn hay tế bào nào. ARN mã hóa cho kháng nguyên đặc hiệu được tổng hợp thành dạng ARN thông tin (mARN) hoặc ARN tự khuếch đại (self-amplifying ARN, saARN) và sau đó kết hợp với các tá dược theo liều lượng và đóng gói. Do tính chất nhất thời của ARN, mARN không xâm nhập vào phần nhân tế bào cũng như mARN sẽ được loại bỏ ngay sau kết thúc dịch mã, dẫn tới việc sẽ không có bất kỳ rủi ro nào xảy ra khi chúng tích hợp với vật liệu di truyền của cơ thể.
Trong cả hai trường hợp, vắc xin cho các loại kháng nguyên khác nhau có thể được sản xuất trong cùng một cơ sở, nhà máy với mục đích tiết kiệm chi phí. Đây cũng là điều khó có thể thực hiện được đối với các loại vắc xin truyền thống thông thường.
Khi bộ gen của mầm bệnh đã được giải trình tự, việc thiết kế, tạo ra bất kỳ loại vắc xin nào có khả năng chống lại protein của nó sẽ trở nên khá nhanh chóng và dễ dàng. Với SARS-CoV-2, ngay sau khi hệ gen SARS-CoV-2 được giải trình tự thành công và công bố, viện Y tế quốc gia Mỹ kết hợp với Moderna đã đẩy mạnh nghiên cứu và đưa vào thử nghiệm lâm sàng vắc xin ARN chứa thông tin mã hóa protein gai của SARS-CoV-2 chỉ trong vòng hai tháng.
Các vắc xin axit nucleic mang thông tin mã hóa kháng nguyên mầm bệnh thường được đưa vào cơ thể qua đường tiêm bắp (bắp tay trên). Hiện có rất nhiều công nghệ được phát triển nhằm hỗ trợ quá trình này, chẳng hạn như kết hợp công nghệ Electroporation, trong đó các xung ngắn của dòng điện được sử dụng để tạo ra các lỗ trống tạm thời trên màng tế bào vật chủ, sau đó một “súng bắn gen (gene gun)” dùng Heli nhằm đẩy ADN vào các lỗ hổng trên tế bào da. Vắc xin ARN cũng có thể được đưa vào cơ thể bằng cách sử dụng một số kỹ thuật tương tự như vắc xin ADN. Thêm vào đó, các axit nucleic này thường được thiết kế bao bọc bởi những hạt nano, có thể dễ dàng hợp nhất với màng tế bào.
Tính tới thời điểm hiện tại, hiện đang có hai vắc xin axit nucleic phòng COVID-19 đã được cấp phép sử dụng khẩn cấp là vắc xin Comirnaty của Pfizer-BioNTech và Spikevax của Moderna với độ hiệu quả lên tới hơn 90%. Chúng đã trở thành những trợ thủ đắc lực trong cuộc chiến đẩy lùi vi rút COVID-19. Việc đầu tư phát triển vắc xin axit nucleic là một thành công không nhỏ của giới khoa học, có đóng góp đặc biệt quan trọng khi thế giới và con người đang phải đối mặt với tình hình dịch bệnh đang ngày càng biến đổi một cách nhanh chóng và phức tạp.
Bảng 1. Ưu và nhược điểm của vắc xin axit nucleic
| Loại vắc xin | ADN | ARN |
| Ưu điểm |
- Tạo đáp ứng miễn dịch bao gồm kích hoạt cả tế bào B và tế bào T (miễn dịch dịch thể và miễn dịch tế bào), mang tính hiệu quả và ổn định cao. |
|
| - Bền | - Không có nguy cơ chèn vào thông tin di truyền của tế bào | |
| Nhược điểm |
- Có thể cần tiêm tăng cường miễn dịch (tiêm nhiều lần). |
|
| - Có khả năng chèn vào thông tin di truyền của tế bào |
- Có khả năng gây đáp ứng interferon do sự hiện diện của ARN ngoại lai trong tế bào |
|
Bảng 2. Một số vắc xin axit nucleic phòng COVID-19 đang được nghiên cứu phát triển
|
Tên |
Giai đoạn thử nghiệm lâm sàng | Thành phần chính | Mũi, liều tiêm, độ tuổi tiêm chủng | Hiệu quả | Đường tiêm, vị trí dung nạp vắc xin |
| Vắc xin ADN | |||||
|
Genexine
|
1/2 | chứa ADN plasmid mã hóa protein gai SARS-CoV-2 | 2 liều cách nhau 28 ngày (18-50 tuổi) | Đang kiểm nghiệm | Tiêm bắp |
|
AnGes |
2/3 | chứa ADN plasmid mã hóa protein gai SARS-CoV-2 | 2 liều cách nhau 14 ngày (20-65 tuổi) | An toàn, có tính sinh miễn dịch sau 1 liều tăng cường | Tiêm bắp |
|
Inovio |
2/3 | chứa ADN plasmid pGX9501 mã hóa protein gai SARS-CoV-2 | 2 liều cách nhau 28 ngày (>18 tuổi) | Có hiệu quả chống lại tình trạng COVID-19 nghiêm trọng và không nghiêm trọng, an toàn có tính sinh miễn dịch sau 1 liều tăng cường | Tiêm trong da (thượng bì) (Electropora-tion) |
|
Symvivo
|
1 | Dòng vi khuẩn Bifidobacterium tái tổ hợp chứa ADN plasmid mã hóa protein gai SARS-CoV-2 |
1 liều |
Đang kiểm nghiệm | Đường miệng |
|
Entos |
1 | ADN plasmid Covigenix VAX-001, kết hợp phân tử vận chuyển proteo-lipid | 2 liều cách nhau 14 ngày (18-84 tuổi) | Đang kiểm nghiệm | Tiêm bắp |
| Vắc xin ARN | |||||
|
Moderna |
Đã được WHO cấp phép sử dụng khẩn cấp vào 30/4/2021 | mARN đã thay đổi nucleoside, lipid, muối, đường sucrose |
2 liều (0,5 ml/liều) cách nhau 28 ngày |
94.1 % (sau khi tiêm được 14 ngày) | Tiêm bắp |
|
Pfizer-BioNTech |
Vắc xin đầu tiên được WHO cấp phép sử dụng khẩn cấp vào 31/12/2020 | mARN được bao bọc bởi hạt nano lipid, axit axetic, chất ổn định axit,muối natri acetat, đường sucrose |
2 liều cách nhau 21 ngày |
95% (sau khi tiêm được 12 ngày) | Tiêm bắp |
|
CureVacAG |
3* | mARN mã hóa toàn bộ độ dài của SARS-CoV-2 được bao bọc bởi hạt nano lipid |
2 liều cách nhau 28 ngày |
Có hiệu quả chống lại tình trạng COVID-19 nghiêm trọng và không nghiêm trọng, an toàn có tính sinh miễn dịch sau 1 liều tăng cường | Tiêm bắp |
|
ChulaCov19 |
1 | mARN mã hóa protein gai của SARS-CoV-2 được bao bọc bởi hạt nano lipid |
2 liều cách nhau 21 ngày |
Đang kiểm nghiệm |
Tiêm bắp |
* Giai đoạn 3 đã hoàn thành, độ an toàn cao nhưng hiệu quả bảo vệ thấp dưới 50% nên chưa được cấp phép sử dụng, nhưng vẫn được tiếp tục nghiên cứu phát triển hoàn thiện.
Bài viết tham khảo các nguồn:
1. Nucleic Acid-Based Vaccine.
https://www.sciencedirect.com/topics/medicine-and-dentistry/nucleic-acid-based-vaccine?fbclid=IwAR3EB6Ax5ecYasbtD3mmnCNYH7AFGJlYjFLavFBdWJvAimZ5tV9URUgFmiY.
2. COVID-19 vaccine tracker and landscape. 13 July 2021;
https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines.
3. Gavi, t.V.A. What are nucleic acid vaccines and how could they be turned against COVID-19? ;
https://www.gavi.org/vaccineswork/what-are-nucleic-acid-vaccines-and-how-could-they-be-used-against-covid-19
4. Organization, W.H. WHO lists additional COVID-19 vaccine for emergency use and issues interim policy recommendations. 7 May 2021; https://www.who.int/news/item/07-05-2021-who-lists-additional-covid-19-vaccine-for-emergency-use-and-issues-interim-policy-recommendations.
5. Silveira, M.M., G. Moreira, and M. Mendonça, DNA vaccines against COVID-19: Perspectives and challenges. Life Sci, 2021. 267: p.118919
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7749647/




Hãy là người bình luận đầu tiên